��Ŀ����
����Ŀ��ʳ�����ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ���ʳ�γ���������CaCl2��MgCl2��FeCl3��Na2SO4���������ӣ�ʵ�����ᴿNaCl���������£�
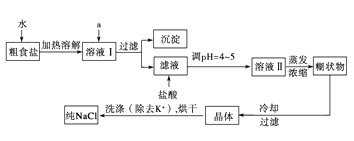
��1������A�Լ�����Ϊ�˳�ȥ��Һ���е�Ca2+��Mg2+��Fe3+��SO42�����ӡ�A�������Ƕ����Լ������μ�˳������Ϊ:i NaOH��ii_________��iii___________���ѧʽ����
��2����д�������Լ������Լ�iʱ������Ҫ��Ӧ�Ļ�ѧ��Ӧ����ʽ��___________________��
��3����ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����______�����ţ���

a��©��ĩ�˾���δ�����ձ���
b����������������
c������ֽʪ��ʹ�����©����
d����ֽ��Ե�߳�©��
e���ò�������©������������Լӿ�����ٶ�
��4���������������_________________________��
��5��m g�����ᴿ��õ�n g������NaCl���壬��m��n�Ĵ�С��ϵΪ______��
A��m��n B��m��n C��m=n D����ȷ����
���𰸡�BaCl2Na2CO3MgCl2+2NaOH=Mg(OH)2��+2NaCl FeCl3+3NaOH =Fe(OH)3��+3NaClade�����ᾧD
��������
(1)���ӹ�����ͨ����������ij����Լ�����Ҫ�������µ����ʣ�����ע���Ⱥ�˳����������ӿ����ñ����ӳ�ȥ����������̼������ӳ�ȥ��ͬʱ̼�������Ҳ���Գ�ȥ����ı����ӣ������ȼ��Ȼ��������̼���ƣ����������������Ϊ��BaCl2��Na2CO3��
��2�������������ƣ���þ���ӷ�Ӧ����������þ�������������ӷ�Ӧ��������������������ѧ����ʽΪ��MgCl2+2NaOH=Mg(OH)2��+2NaCl��FeCl3+3NaOH =Fe(OH)3��+3NaCl������������������ǣ�MgCl2+2NaOH=Mg(OH)2��+2NaCl��FeCl3+3NaOH =Fe(OH)3��+3NaCl��
��3���ڹ���ʱע��һ��������������ֽ����©���ڱڣ���ֽ��Ե����©����Ե��Һ�������ֽ��Ե������������������ֽһ�࣬�ձ����ڲ�������������©���¶˽����ձ��ڱڣ�ͬʱ���������ܽ��н��裬������ade���淶������������������ǣ�ade��
��4��������Ϊ���Ȼ�����Һ�еõ��Ȼ��ƹ��壬Ϊ�����ᾧ����˱�����ǣ������ᾧ��
��5���ڴ����ᴿ�����м����������Ӻ������ӣ����Բ���ȷ��ǰ���������ϵ���ʴ�ΪD������������������ǣ�D��

����Ŀ������ʵ����������Ӧ�������Լ����۶���ȷ���ǣ� ��
ѡ�� | ʵ�� | ���� | ���� |
A | ����з�̪��Na2CO3��Һ�м���BaCl2���� | ��Һ��ɫ��dz | Na2CO3��Һ�д���ˮ��ƽ�� |
B | ������¯ˮ���е�CaSO4 ʱ���� �μ��뱥��Na2CO3��Һ������ | ˮ���ܽ� | Ksp��CaCO3��CaSO4 |
C | �����������䣬ƽ����ϵ�� FeCl3(aq)+3KSCN(aq) +3KCl(aq)�У���KCl ���� | ��ɫ��dz | ֤������������KCl��Ũ�ȣ�ʹԭ��Һ�л�ѧƽ�������ƶ� |
D | ��Ũ�Ⱦ�Ϊ0.1 mol��L��1��NaCl��NaI�����Һ�еμ�����AgNO3��Һ | �ȳ��� ��ɫ���� | Ksp��AgCl��AgI |
A. A B. B C. C D. D





