题目内容
【题目】如图所示,分别向密闭容器内可移动活塞的两边充入空气,H2和O2的混合气体,在标准状态下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为

A.2∶7 B.5∶4 C.2∶1 D.7∶2
【答案】D
【解析】
试题分析:阿伏伽德罗定律的推论,恒温恒压下,气体的体积之比等于其物质的量之比。可以假设空气的物质的量为1 mol,H2、O2反应后剩余的气体也是1 mol。若剩余气体的是1 mol H2,则H2、O2的体积比为2:3恰好反应,即H2是4/3 mol,O2是6/3 mol,则原来H2、O2的体积比是7:2;若剩余气体的是1 mol O2,则原来H2、O2的体积比是4:5,选项D符合题意。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( ) 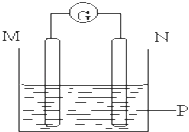
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A
B.B
C.C
D.D