题目内容
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
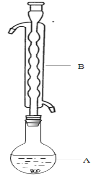
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
【答案】(1)冷凝管或冷凝器;冷凝回流;增加反应物的接触面积,加快反应速率;
(2)蒸发浓缩、冷却结晶 (3)Na2SO4;取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4;
(4)酸式;103.2%;其中含有的Na2SO3也会和I2发生反应,从而影响纯度
【解析】
试题分析:(1)根据仪器的结构可判断仪器B是冷凝管,起冷凝回流的作用。硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润的目的是使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接触,加快反应速率;
(2)通过蒸发浓缩,冷却结晶,过滤洗涤,干燥等步骤得到溶液中的溶质固体;
(3)S2O32具有还原性,能够被氧气氧化成硫酸根离子,滤液中除Na2S2O3和可能未反应完全的Na2SO3外,存在被氧化产物硫酸钠,所以可能存在的杂质是硫酸钠,其检测的方法依据硫酸根离子检验:取出少许溶液,加盐酸至酸性后,取上层清液或过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:Na2SO3+2HCl═SO2↑+H2O+2NaCl,Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl,取出少许溶液,加稀盐酸至酸性,静置后,取上层清液,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含;
(4)碘水呈酸性,应用酸式滴定管盛装,第2次滴定的误差较大,舍去,碘的物质的量为:0.0500molL-l×![]() L=0.00154mol
L=0.00154mol
2S2O32- + I2═S4O62-+2I-
2 1
x 0.00154mol
解得:x=0.00308mol,故Na2S2O35H2O的物质的量为0.00308mol,质量为:0.00308mol×248g/mol=0.76384g,则称取7.40g产品,配制成250mL溶液中,Na2S2O35H2O的质量为=0.76384g×![]() =7.6384g,故产品的纯度为:
=7.6384g,故产品的纯度为:![]() ×100%=103.2%,碘单质有强的氧化性,Na2SO3具有还原性,Na2SO3会和I2发生反应,从而影响纯度。
×100%=103.2%,碘单质有强的氧化性,Na2SO3具有还原性,Na2SO3会和I2发生反应,从而影响纯度。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3= + 44.0kJ·mol-1
H2O(g)ΔH3= + 44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的逆反应平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.增大CO2和H2的初始投料比 E.投料比不变,增加反应物的浓度
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。