��Ŀ����
����Ŀ����Ȳ���ڴ��������¿ɷ���ż����Ӧ����ΪGlaser��Ӧ��
2R��C��C��H![]() R��C��C��C��C��R+H2
R��C��C��C��C��R+H2
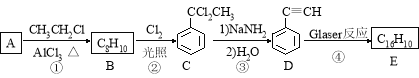
�÷�Ӧ���о����ͷ�����ϡ������ӻ�ѧ�ȷ��������Ҫ��ֵ������������Glaser��Ӧ�Ʊ�������E��һ�ֺϳ�·�ߣ�
�ش��������⣺
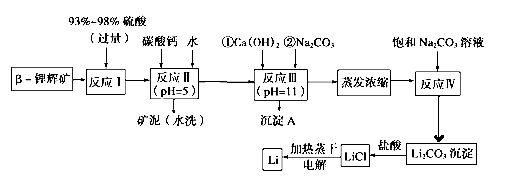
��1��B�Ľṹ��ʽΪ ��D �Ļ�ѧ����Ϊ ��
��2���ٺ͢۵ķ�Ӧ���ͷֱ�Ϊ �� ��
��3��E�Ľṹ��ʽΪ ����1 mol E�ϳ�1��4-���������飬��������Ҫ��������_______mol��
��4��������(HC��C![]() C��CH)Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪ_______________________��
C��CH)Ҳ�ɷ���Glaserż����Ӧ���ɾۺ���þۺϷ�Ӧ�Ļ�ѧ����ʽΪ_______________________��
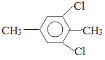
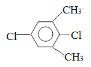
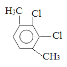
��5�����㻯����F��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ3:1��д������һ�ֵĽṹ��ʽ_____________________��
��6��д����2-�����Ҵ�Ϊԭ�ϣ��������Լ���ѡ���Ʊ�������D�ĺϳ�·�� ��
���𰸡���1��![]() ������Ȳ
������Ȳ
��2��ȡ����Ӧ����ȥ��Ӧ
��3��![]() 4
4
��4��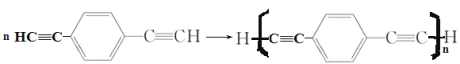 +(n-1)H2
+(n-1)H2
��5��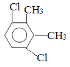 ��
�� ��
�� ��
�� ��
��
��6��![]()
��������
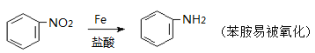
�����������1��A�������鷢��ȡ����Ӧ����B�������B����ʽ��֪A�DZ���B�DZ����飬��B�Ľṹ��ʽΪ![]() ������D�Ľṹ��ʽ��֪D �Ļ�ѧ����Ϊ����Ȳ��
������D�Ľṹ��ʽ��֪D �Ļ�ѧ����Ϊ����Ȳ��
��2�����DZ�������ԭ�ӱ��һ�ȡ��������ȡ����Ӧ�����в���̼̼��������±��������ȥ��Ӧ��
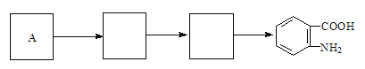
��3��D������֪��Ϣ�ķ�Ӧ�����E�Ľṹ��ʽΪ![]() ��1��̼̼������Ҫ2���������ӳɣ�����1 mol E�ϳ�1��4-���������飬��������Ҫ��������4mol��
��1��̼̼������Ҫ2���������ӳɣ�����1 mol E�ϳ�1��4-���������飬��������Ҫ��������4mol��
��4��������֪��Ϣ��֪������![]() ����Glaserż����Ӧ���ɾۺ���Ļ�ѧ����ʽΪ
����Glaserż����Ӧ���ɾۺ���Ļ�ѧ����ʽΪ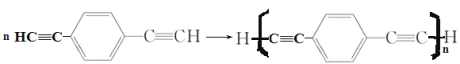 +(n-1)H2��
+(n-1)H2��
��5�����㻯����F��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ3:1���ṹ��ʽΪ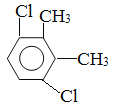 ��
��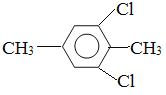 ��
��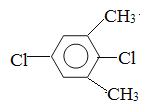 ��
��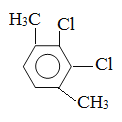 ��
��
��6��������֪��Ϣ�Լ��Ҵ������ʿ�֪��2-�����Ҵ�Ϊԭ�ϣ��������Լ���ѡ���Ʊ�������D�ĺϳ�·��Ϊ![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��Na2S2O3�׳ƴ��մ���������Ҫ�Ļ���ԭ�ϡ���Na2SO3�������ˮ��Һ�м��ȷ�Ӧ�������Ƶ�Na2S2O3����֪10����70��ʱ��Na2S2O3��100gˮ�е��ܽ�ȷֱ�Ϊ60.0g��212g�������£�����Һ�������ľ�����Na2S2O3��5H2O��
��ʵ��������ȡNa2S2O3��5H2O���壨Na2S2O3��5H2O�ķ�����Ϊ248���������£�
�ٳ�ȡ12.6g Na2SO3���ձ��У�����80.0mLˮ��
����ȡ4.0g��ۣ��������Ҵ���ʪ�ӵ�������Һ�С�
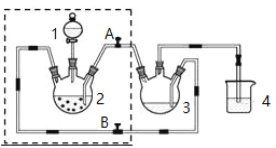
�ۣ���ͼ��ʾ������װ����ȥ����ˮԡ���ȣ��У���ӦԼ1Сʱ����ˡ�
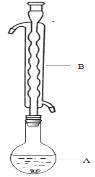
����Һ�ھ��� �� ������Na2S2O3��5H2O���塣
�ݽ��м�ѹ���˲����
��1������B��������________����������___________�������������Ҵ���ʪ��Ŀ���� ��
��2�������Ӧ��ȡ�IJ����� �� ��
��3����Һ�г�Na2S2O3�Ϳ���δ��Ӧ��ȫ��Na2SO3�⣬����ܴ��ڵ��������� �������Һ�и����ʵĺ������ܵͣ�����ķ����ǣ� ��
��4��Ϊ�˲��Ʒ�Ĵ��ȣ���ȡ7.40g ��Ʒ�����Ƴ�250mL��Һ������Һ����ȡ25.00mL����ƿ�У��μ�������Һ��ָʾ��������Ũ��Ϊ0.0500mol/L �ĵ�ˮ���� �����ʽ����ʽ�����ζ������ζ���2S2O32�� + I2 �� S4O62�� + 2I�������ζ�������£�
�ζ����� | �ζ�ǰ������mL�� | �ζ��ζ��������mL�� |
��һ�� | 0.30 | 31.12 |
�ڶ��� | 0.36 | 31.56 |
������ | 1.10 | 31.88 |
�����ò�Ʒ�Ĵ���Ϊ ������ΪӰ�촿�ȵ���Ҫԭ���ǣ������Dz��������� ��