题目内容
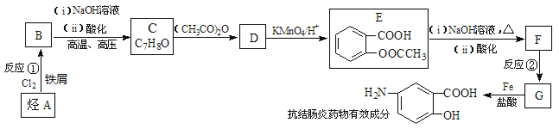
【题目】已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如下图所示。
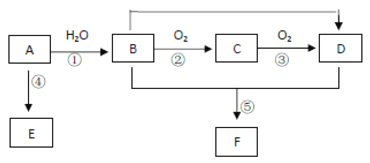
回答下列问题:
(1)工业上由石蜡制取 A 的方法称作: ____________________。
(2)反应⑤的化学方程式:______________________________。
(3)下列有关 A 和 E 的叙述正确的是__________。
a.均能使溴水褪色 b.均只含极性键 c.最简式相同 d.均属于纯净物
![]() (4)写出由 B、O2 和 KOH 溶液组成的燃料电池的负极反应式:____________________。
(4)写出由 B、O2 和 KOH 溶液组成的燃料电池的负极反应式:____________________。
【答案】(1)裂解
(2) CH3COOH+ CH3CH2OH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
(3)c
(4)C2H5OH - 12e- + 16OH- = 2CO32- + 11H2O
【解析】
试题分析:A的产量是衡量一个国家石油化工生产水平的标志,则A是乙烯。乙烯含有碳碳双键,能和水发生加成反应生成乙醇,即B是乙醇。乙醇发生催化氧化生成乙醛,则C是乙醛。乙醛氧化生成乙酸,则D是乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯,F为乙酸乙酯,以乙烯主要原料合成高分子化合物 E,则E是聚乙烯。
(1)工业上由石蜡制取乙烯的方法叫裂解。
(2)反应⑤是乙酸与乙醇在浓硫酸作催化剂加热的条件发生反应生成乙酸乙酯,反应的化学方程式为:CH3COOH+ CH3CH2OH ![]() CH3COOCH2CH3 + H2O 。
CH3COOCH2CH3 + H2O 。
(3)根据上述分析,A为乙烯,E为聚乙烯,乙烯中含有碳碳双键,而聚乙烯中只有碳碳单键,只有乙烯能使溴水褪色,a项错误;它们有C-C非极性键,b项错误;最简式均为CH2,最简式相同,c项正确;乙烯是纯净物,而聚乙烯属于混合物,d项错误;答案选c。
(4)由 乙醇、O2 和 KOH 溶液组成的燃料电池中,乙醇失电子发生氧化反应生成CO2和水,生成的二氧化碳与KOH反应生成碳酸钾,所以该电池的负极反应式:C2H5OH - 12e- + 16OH- = 2CO32- + 11H2O。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
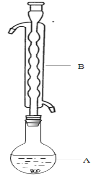
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。