题目内容
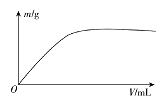
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质:向含W元素的钠盐溶液中通入x的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
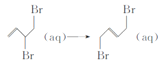
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.W一定位于周期表中第三周期IIIA族
C.X的含氧酸的酸性可能比Z的含氧酸的酸性强
D.Z和W组成的化合物可能是离子化合物
【答案】C
【解析】
X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层,X为C元素;Y广泛作电池材料且单位质量的金属提供电子数目最多,Y为Li元素;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质,Z为Cl元素;向含W元素的钠盐溶液中通入x的氧化物,产生沉淀且不溶解,W为Al或Si元素,据此分析解答。
由上述分析可知:X为C元素;Y为Li元素;Z为Cl元素;W为Al或Si元素。
A、Li在空气中燃烧不能生成过氧化物,故A错误;
B、W为Al或Si元素,不一定位于周期表中第三周期IIIA族,故B错误;
C、X为C元素,其含氧酸可能是碳酸,Z为Cl元素,其含氧酸可能是次氯酸,碳酸的酸性强于次氯酸,故C正确;
D、Z为Cl元素,W为Al或Si元素,Z和W组成的化合物可能为四氯化碳或氯化铝,两者都是共价化合物,故D错误。
答案选C。

【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为__,第二周期第一电离能比B高的元素有__种。
(2)B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__(标出配位键),其中心原子的VSEPR模型名称为__,写出[BH4]-的两种等电子体__。
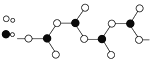
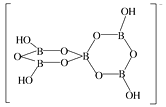
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为__(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__。
图1 | 图2 | 图3 |
|
|
|
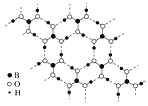
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有__。
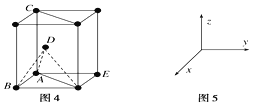
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E、C的坐标分别为B(1,0,0)、E(0,1,0)、C(0,0,1),请写出D点的坐标:D:___。