题目内容
【题目】化合物M是一种抗心率失常药物中间体,实验室由化合物A、B制备M的一种合成路线如图所示:

已知:①R1COR2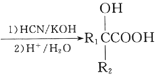 (R1、R2表示氢原子或烃基)
(R1、R2表示氢原子或烃基)
②![]() (-NH2易被氧化)
(-NH2易被氧化)
③RCOOH![]() RCOCl
RCOCl
请回答下列问题:
(1)A中官能团的名称为__,B的化学名称为__。
(2)C的结构简式为__。
(3)由B生成F的反应类型为__。
(4)由E与G反应生成H的化学方程式为___。
(5)反应I中加入的过量NH3,除作为反应物外,另一个作用为___。
(6)同时满足下列条件的M的同分异构体有___种(不考虑立体异构)。
①苯环上连有3个取代基,其中2个为-NH2
②能发生银镜反应
③核磁共振氢谱中有6组吸收峰
(7)参照上述合成路线和信息,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:__。
的合成路线:__。
【答案】醛基 间二甲苯(或1,3-二甲基苯) ![]() 取代反应(或硝化反应)
取代反应(或硝化反应) 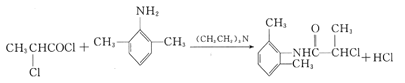 吸收反应生成的HCl,提高转化率 4
吸收反应生成的HCl,提高转化率 4 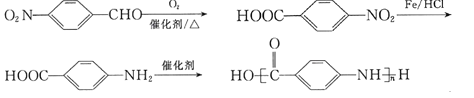
【解析】
由题意可知,A为CH3CHO,根据信息①可推出C的结构简式为![]() ,由信息③可推出E的结构简式为CH3CH(OH)COCl,由H结构结合B的分子式可判断出B为
,由信息③可推出E的结构简式为CH3CH(OH)COCl,由H结构结合B的分子式可判断出B为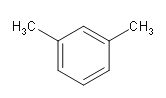 ,B到F发生硝化反应,F的结构为
,B到F发生硝化反应,F的结构为 ,F到G发生还原反应,G的结构为
,F到G发生还原反应,G的结构为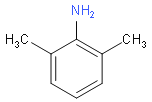 ,H到M发生取代反应,由此解答。
,H到M发生取代反应,由此解答。
(1)A中官能团的名称为醛基,B的化学名称为间二甲苯或1,3-二甲基苯,故答案为:醛基;间二甲苯(或1,3-二甲基苯);
(2)C的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)由B生成F的反应类型为取代反应或硝化反应,故答案为:取代反应(或硝化反应);
(4)由E与G反应生成H的化学方程式为: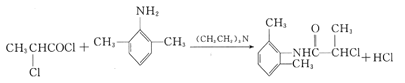 ,故答案为:
,故答案为: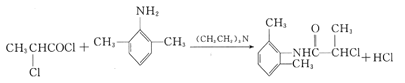 ;
;
(5)反应I中加入的过量NH3,除作为反应物外,另一个作用为吸收反应生成的HCl,提高转化率,故答案为:吸收反应生成的HCl,提高转化率;
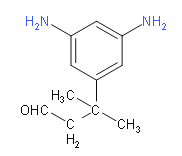
(6)M的同分异构体要满足下列条件:①苯环上连有3个取代基,其中2个为-NH2,说明剩余的碳原子和氧原子只能连成一个取代基;②能发生银镜反应,说明有醛基;③核磁共振氢谱中有6组吸收峰,说明有6种等效氢,应该为对称结构;综上分析可知,两个氨基应该连在间位上,第三个取代基连在与它们相邻或相间的位置上,具体结构如下:
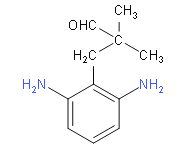 ;
;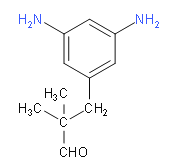 ;
;
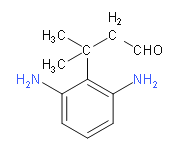 ;共4种;故答案为:4;
;共4种;故答案为:4;
(7)以![]() 为原料合成
为原料合成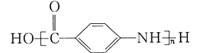 ,应先将醛基氧化为羧基,再将硝基还原为氨基,最后发生加聚反应即可,合成路线为:
,应先将醛基氧化为羧基,再将硝基还原为氨基,最后发生加聚反应即可,合成路线为: ,故答案为:
,故答案为: 。
。

 名校课堂系列答案
名校课堂系列答案