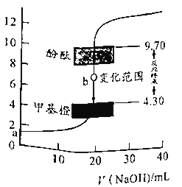
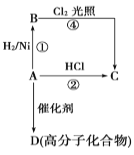
题目内容
【题目】探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为____。
仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体
实验方案:请仿照教材设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点____。
【答案】KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O 
【解析】
KMnO4酸性溶液与H2C2O4溶液反应生成硫酸钾、硫酸锰、二氧化碳和水。
KMnO4酸性溶液与H2C2O4溶液反应生成硫酸钾、硫酸锰、二氧化碳和水,反应的化学方程式为KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;据题给条件,设计探究Mn2 +对KMnO4酸性溶液与H2C2O4溶液反应速率的影响的实验,应用取两份等体积的0.01mo/LKMnO4酸性溶液,一份加入0.1mol/L的H2C2O4溶液,另一份加入等体积的0.1mol/L的H2C2O4溶液和硫酸锰固体,测定溶液由紫色褪为无色所需要的时间,实验用表格如下:
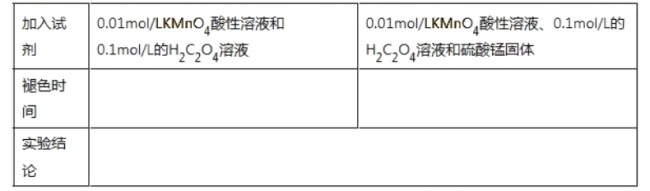
故答案为:KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;  。
。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】根据下列实验现象,所得结论正确的是
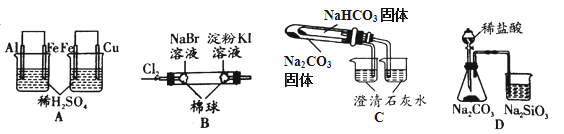
实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D