题目内容
【题目】硫化钠广泛应用于染料工业。请完成下列各题:
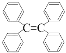
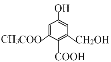
(1)写出![]() 的电子式____________,比较
的电子式____________,比较![]() 和
和![]() 的熔点高低:
的熔点高低:![]() ____
____![]() 。
。
(2)O、S属于同主族元素,其单质的氧化性不同,用反应的化学方程式表示______________,O、S、![]() 半径从大到小的顺序是_______________。
半径从大到小的顺序是_______________。
【答案】![]() > 2H2S+O2=2S↓+2H2O S2->S>O
> 2H2S+O2=2S↓+2H2O S2->S>O
【解析】
Na2O是离子晶体,Na+和O2-之间是离子键,比较离子晶体熔点高低就是比较晶格能大小,晶格能越大,离子晶体熔点越高;O、S属于同主族元素,其单质的氧化性不同,如O2能氧化H2S生成S,非金属元素的阴离子半径大于其原子半径,同主族元素从上而下原子半径逐渐增大。
(1)Na2O是离子晶体,Na+和O2-之间是离子键,则Na2O的电子式为:![]() ,Na2O和Na2S均为离子晶体,比较离子晶体熔点高低就是比较晶格能大小,O2-半径比S2-半径小,二者电荷相同,则Na2O的晶格能大于Na2S的晶格能,所以熔点高低:Na2O>Na2S,
,Na2O和Na2S均为离子晶体,比较离子晶体熔点高低就是比较晶格能大小,O2-半径比S2-半径小,二者电荷相同,则Na2O的晶格能大于Na2S的晶格能,所以熔点高低:Na2O>Na2S,
故答案为:![]() ;>;
;>;
(2)O、S属于同主族元素,其单质的氧化性不同,如O2能氧化H2S生成S,反应方程式为:2H2S+O2═2S↓+2H2O,非金属元素的阴离子半径大于其原子半径,同主族元素从上而下原子半径逐渐增大,所以O、S、S2-半径从大到小的顺序是:S2->S>O,故答案为;2H2S+O2═2S↓+2H2O;S2->S>O。

【题目】硼酸三丁酯的结构简式为B(OCH2CH2CH2CH3)3,常温常压下为略带香味的油状液体,是一种重要的含硼有机物,主要用作有机溶剂、脱水剂和催化剂,其一种实验室制备的原理为H3BO3+3CH3CH2CH2CH2OH![]() B(OCH2CH2CH2CH3)+3H2O,装置如图所示(夹持装置及微波加热装置已略去):
B(OCH2CH2CH2CH3)+3H2O,装置如图所示(夹持装置及微波加热装置已略去):

实验步骤如下:
Ⅰ.向微波专用圆底烧瓶中加入磁力搅拌子,并加入6.2 g硼酸(H3BO3)和47.4 mL正丁醇(CH3CH2CH2CH2OH)以及1.0 g NaHSO4H2O;
Ⅱ.微波加热:60℃下2 min,80℃下2 min,90℃下5 min,100℃下2 min,118℃下2 min;回流分水;
Ⅲ.待反应结束后,蒸馏得产品20.2 g。
已知:正丁醇的密度为0.81 g.cm-3。
请回答下列问题:
(1)分水器使用前需检查 ___,分水器的作用是 ___(任写一条)。
(2)图中仪器X的名称为 ___,其进水口应为____(填“a”或“b”)口。
(3)为了提高转化率,常用带水剂把生成的水从反应体系中分离出。分别以下列四种物质作为制备硼酸三丁酯的带水剂,结果如表所示,该实验选择正丁醇作带水剂,优点是____。
带水剂种类 | 甲苯 | 苯 | 环己烷 | 正丁醇 |
产率/% | 78.2 | 83.4 | 80.4 | 80.5 |
(4)步骤II中需要在不同温度下进行加热,并控制好时间,加热方式采用微波加热的优点是 ___;实验过程中发现,随着微波加热时间延长,硼酸三丁酯的产率增加,但当加热时间超过13 min后,产率增加幅度明显减小,造成此现象可能的原因是___。
(5)蒸馏装置中仪器的选择和安装均正确的是____(填选项字母)。
A. 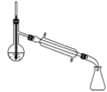 B.
B. 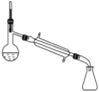 C.
C.  D.
D. 
(6)本实验中硼酸三丁酯的产率为____(保留三位有效数字)。