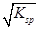题目内容
根据水溶液中存在的平衡关系,判断下列说法正确的是
| A.往水中滴加少量氢氧化钠稀溶液,Kw变小 |
| B.往AgCl悬浊液中加入0.1mol·L-1NaI溶液,无明显现象产生 |
| C.室温下,稀释0.1mol·L-1的醋酸,溶液中c(CH3COO-)·c(H+)不变 |
| D.等体积等浓度的氨水与盐酸混合后所得溶液显酸性 |
D
解析试题分析:A、水的离子积常数只与温度有关系,因此往水中滴加少量氢氧化钠稀溶液,水的电离被抑制,但Kw不变,A不正确;B、碘化银的溶度积常数小于氯化银的溶度积常数,因此往AgCl悬浊液中加入0.1mol·L-1NaI溶液,有碘化银生成,B不正确;C、醋酸是弱酸,存在电离平衡,稀释促进电离,电离常数不变,所以所以室温下,稀释0.1mol·L-1的醋酸,溶液中c(CH3COO-)·c(H+)减小,C不正确;D、氨水是弱碱,等体积等浓度的氨水与盐酸混合后生成氯化铵,NH4+水解所得溶液显酸性,D正确,答案选D。
考点:考查溶液酸碱性、电离平衡、溶解平衡以及溶液中盐类水解的应用

练习册系列答案
相关题目
如图表示水溶液中c(H+)和c(OH-)的关系,下列说法正确的是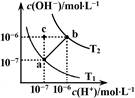
| A.ab线上任意点溶液均显中性 |
| B.b点时,溶液的pH=6,显酸性 |
| C.图中温度T1>T2 |
| D.在水中通入适量HCl气体可从a点变到c点 |
常温下,用 0.01 mol·L-1NaOH溶液滴定 20.00 mL 0.01 mol·L-1 CH3COOH溶液,所得滴定曲线如图。下列说法正确的是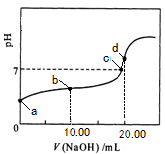
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
下列化学实验事实及其解释或结论都正确的是( )
| A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| B.用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯,用饱和的Na2CO3溶液可以洗去其中含有的乙醇和乙酸,说明乙酸乙酯在Na2CO3溶液中的溶解度很小 |
| C.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
| D.配制0.10mol/L NaCl溶液,俯视容量瓶的刻度线定容,所配溶液浓度偏大 |
下列物质的水溶液中,除了水分子外,不存在其他分子的是( )。
| A.HCI | B.NH4NO3 | C.Na2S | D.HClO |
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A.将溶液稀释到原体积的 10倍 |
| B.加入适量的醋酸钠固体 |
| C.加入等体积0.2 mol·L-1盐酸 |
| D.提高溶液的温度 |
蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
| A.FeCl3 | B.FeCl3·6H2O | C.Fe(OH)3 | D.Fe2O3 |