题目内容
下列化学实验事实及其解释或结论都正确的是( )
| A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| B.用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯,用饱和的Na2CO3溶液可以洗去其中含有的乙醇和乙酸,说明乙酸乙酯在Na2CO3溶液中的溶解度很小 |
| C.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
| D.配制0.10mol/L NaCl溶液,俯视容量瓶的刻度线定容,所配溶液浓度偏大 |
D
解析试题分析:A、取少量溶液X,向其中加入适量新制氯水,若有Fe2+,已经被氧化为Fe3+,再加KSCN溶液,溶液变红,不能说明原溶液中有Fe2+,错误;B、用乙醇、冰醋酸及浓H2SO4加热才可以制乙酸乙酯,错误;C、向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,若先生成蓝色沉淀,说明氢氧化铜的溶度积常数小,错误;D、配制溶液,俯视刻度线,体积变小,浓度偏大,正确。
考点:考查物质的制备原理、实验原理

下列选项正确的是
| A.0.l mol·L-1的NaHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| B.等物质的量浓度的三种溶液:①(NH4)2CO3②NH4Cl ③(NH4)2Fe(SO4)2中,c(NH4+)的大小顺序为:③>②>① |
| C.25℃时,pH=4的KHC2O4溶液中:c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| D.CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
根据水溶液中存在的平衡关系,判断下列说法正确的是
| A.往水中滴加少量氢氧化钠稀溶液,Kw变小 |
| B.往AgCl悬浊液中加入0.1mol·L-1NaI溶液,无明显现象产生 |
| C.室温下,稀释0.1mol·L-1的醋酸,溶液中c(CH3COO-)·c(H+)不变 |
| D.等体积等浓度的氨水与盐酸混合后所得溶液显酸性 |
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是
| A.氨水的浓度等于盐酸的浓度 |
| B.原氨水中有1%的含氮微粒为NH4+ |
| C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1 |
已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s) 2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是
2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是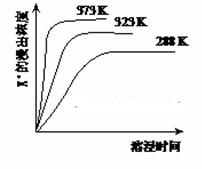
| A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C.升高温度,反应速率增大,平衡向正反应方向移动 |
| D.该平衡的Ksp= c(Ca2+) ·c(K+)·c(Mg2+)·c(SO42-) |
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是 ( )
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入NH4Cl固体 ⑤向水中加入NaHCO3固体 ⑥向水中加入NaHSO4固体
| A.①②⑤ | B.①④ | C.③④⑥ | D.④ |
室温下,取0.3 mol·L-1HY溶液与0.3 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是 ( )
| A.混合溶液中由水电离出的c(OH-)=10-9 mol·L-1 |
| B.溶液中离子浓度由大到小的顺序为c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.混合溶液中c(Na+)=c(Y-)+c(HY)=0.3 mol·L-1 |
| D.混合溶液中c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1 |
25℃时,将a mol·L-1一元酸HA与b mol·L-1 NaOH等体积混合后测得溶液pH=7,则下列关系一定不正确的是( )
| A.a=b | B.a>b |
| C.c(A-)=c(Na+) | D.c(A-)<c(Na+) |
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A.等浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HC
 )+2c(C
)+2c(C )
)