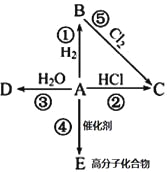
��Ŀ����
����Ŀ������������ɫ��״Һ��е�Ϊ38.4�棬������ˮ�������ڶ����л��ܼ�����NaBr���塢C2H5OH��ŨH2SO4��ˮΪԭ�ϣ��Է�Ӧ��Ļ��Һ�ȿ����ձ��еõ��ֲ�Ʒ�������飩����Ӧװ����ͼ������ȥ�гֺͼ���װ�ã�����Ӧԭ������NaBr+H2SO4��Ũ��=NaHSO4+HBr����CH3CH2OH+HBr![]() CH3CH2Br+H2O�������й�˵����ȷ���ǣ� ��
CH3CH2Br+H2O�������й�˵����ȷ���ǣ� ��
A.��ƿ���Լ�������Ⱥ�˳��Ũ���ᡢˮ���廯�ơ��Ҵ�
B.���� װ�ô��浹��©��װ��
װ�ô��浹��©��װ��
C.����ˮ��b�ڽ�a�ڳ�
D.�ֲ�Ʒ��ˮϴ�ӡ������ᾧ�õ�������������
���𰸡�B
��������
A��Ũ��������ˮ�ų��������ȣ����Ũ����Ӧ����ˮ�У������������ܹ���ʱɢ����ȥ������ƿ���ȼ�Ũ������ˮ���ײ���Һ��ɽ�������Σ�գ�A����
B����Ӧ�漰��HBr�ӷ��Ҽ�������ˮ������©���������Ƿ�������Ҳ���� װ�ô��棬B��ȷ��
װ�ô��棬B��ȷ��
C��Ϊ�ﵽ�Ϻõ�����Ч��������ˮӦa�ڽ�b�ڳ���C����
D�������鳣����Ϊ������ˮ��Һ�壬��Һ���ɷ��룬�������ᾧ�ò��������飬D����
��ѡB��

����Ŀ����һ����ɫ�����ĩ����FeCl3��CaCO3��Na2SO4��KCl��Ba(NO3)2�еļ���������ɣ�ȡ��Ʒ��������ʵ�飨�������й����У��ܷ�Ӧ������֮��ķ�Ӧǡ����ȫ����

��1����������÷��뷽������___��Ҫ�Ӳ�������á���ɫ��Һ������ȡ�ܼ������÷��뷽������___��
��2��д��ʵ������з�����ѧ��Ӧ�����ӷ���ʽ��___����___��
��3�������ĩ��һ�������ڵ������ǣ��ѧʽ����ͬ��___������ȷ���Ƿ���ڵ�������___��
��4���������ĩ���ܵ���������±������Բ�������Ҳ�����ٲ��䣩��___
��� | ��ѧʽ |
�� | |
�� | |
��5�����һ��ʵ�飬��һ��ȷ����������ɣ�����ʵ�����������ͽ��ۡ�___
����Ŀ���к͵ζ��Ǹ��л�ѧ��Ҫ�Ķ���ʵ�顣��ش��������⣺
��1���ñ�����ζ�δ֪Ũ�ȵ�NaOH��Һ�������������ɲⶨ���ƫ�ߵ���____(��ѡ����ĸ)��
A.�ζ��յ����ʱ�����ӵζ��̶ܿ�
B.ʢװNaOH��Һ����ƿ������ˮϴ����δ��NaOH��Һ��ϴ
C.��ʽ�ζ���������ˮϴ����δ�ñ�������ϴ
D.�ζ�ǰ���ζ��ܼ��������ݣ��ζ���������ʧ
��2��ȡ������Һ������ƿ�У���������ϡ���ᣬ��Ũ��Ϊ0.02mol��L��1�ĸ��������Һ�ζ���������Ӧ�����ӷ���ʽΪ��____��
��3��һ�ζ��������£�
�ζ����� | ����Һ���(mL) | ��KMnO4��Һ���(mL) | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 25.00 | 0.50 | 20.40 |
�ڶ��� | 25.00 | 3.00 | 23.00 |
������ | 25.00 | 4.00 | 24.10 |
�ٵζ�ʱ���÷�Ӧ���ʿ�ʼʮ�ֻ�����һ��ʱ���ͻȻ�ӿ죬������Ϊ____�������ӣ��Ը÷�Ӧ���д����ã�KMnO4��ҺӦװ��____(����������������)ʽ�ζ����У��ζ��յ��������____��
�ڸò�����Һ�����ʵ���Ũ��Ϊ_____��
����Ŀ�����ֶ�����Ԫ�ص�����Ϣ�����
Ԫ�ش��� | Q | R | X | Z |
����Ϣ | ���ӣ� | ���ʷ��ӣ�R2 | ���ӣ�X3+ | һ��ԭ�ӣ� |
��֪Q��R��X���ڵ������ڣ�R2���³�ѹ��Ϊ����ɫ���塣
���������գ�
��1��Q�����ڱ���λ���ǣ�___��������Q2Z�ĵ���ʽΪ___��
��2��Q��R��X��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ___����Ԫ�ط��ű�ʾ����Q��R��X��Z�н�������ǿ����___����Ԫ�ط��ű�ʾ����
��3��Q��X���ߵ�����������Ӧ��ˮ����֮�䷢����Ӧ�ķ���ʽΪ____��