题目内容
【题目】关注饮用水,保证生活质量。请回答下列问题:
(1)饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为: 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为: 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。
上述反应中,_________元素的化合价升高,则该元素的原子_______(填“得到”或“失去”)电子。当有1mol N2生成时,反应中转移电子的数目为____________。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳 [Ca(OH)2]制取漂白粉,化学方程式为:__________________。
(3)KA1(SO4)212H2O的俗名为明矾,因其溶于水生成_____________(化学式)可以吸附杂质,从而达到净水作用。向饱和明矾溶液滴加稀氢氧化钠溶液至过量,用离子方程式和必要文字描述过程现象:_____________。
【答案】Al 失去 6.02×1024 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Al(OH)3 先产生白色沉淀,后白色沉淀溶解Al3++3OH-= Al(OH)3,Al(OH)3+OH-= [Al(OH)4]-
【解析】
(1)氧化还原反应中,元素化合价升高被氧化,元素化合价降低后的产物为还原产物,结合方程式:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中,Al元素化合价升高,被氧化,N元素化合价降低,被还原,结合化合价的变化判断电子的得失以及电子转移的方向和数目;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(3)结合KA1(SO4)212H2O中的A13+的性质进行回答。
(1)由化学反应10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中,A1元素化合价升高,被氧化,在反应中失去电子,铝失去电子数为10![]() 3,NaNO3得到电子数为6×5,当有1molN2生成时,反应中转移电子的数目为6.02×1024;故答案为:Al;失去;6.02×1024;
3,NaNO3得到电子数为6×5,当有1molN2生成时,反应中转移电子的数目为6.02×1024;故答案为:Al;失去;6.02×1024;
(2)石灰乳和氯气反应生成氯化钙和次氯酸钙、水,而氯化钙和次氯酸钙为漂白粉的主要成分,,该反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;故答案为: 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)KA1(SO4)2.12H2O的俗名明矾,在水中电离出的铝离子能发生水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,可以吸附杂质,从而达到净水作用;向饱和明矾溶液滴加稀氢氧化钠溶液至过量,先产生白色沉淀,其离子反应方程式为:Al3++3OH-= Al(OH)3,继续滴加至过量,白色沉淀逐渐溶解,其离子反应方程式为Al(OH)3+OH-= AlO2-+ 2H2O;
故答案为:明矾;Al(OH)3;Al3++3OH-= Al(OH)3,;Al(OH)3+OH-= AlO2-+ 2H2O。

【题目】如图装置可用于收集气体并验证其某些化学性质能达到目的是
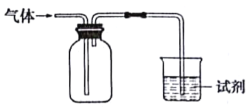
选项 | 气体 | 试剂 | 现象 | 结论 |
A | NH3 | 酚酞试液 | 溶液变红色 | 氨水显碱性 |
B | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
C | C2H4 | 溴水 | 溶液褪色 | C2H4分子中含碳碳双键 |
D | X | KI淀粉溶液 | 溶液变蓝 | X可能是NO2 |
A.AB.BC.CD.D



