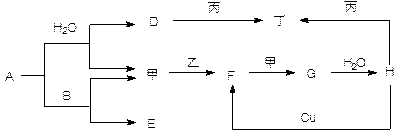题目内容
(14分)X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少、构成蛋白质的重要组成元素;Z的基态原子核外9个轨道上填充了电子,且核外有2个未成对电子,与Y不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1) 常温常压下Z单质是_______晶体(填类型),微粒间通过______形成晶体(填微粒间相互作用的类型)。Y2分子中存在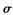 键和
键和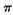 键个数之比为____________。
键个数之比为____________。
(2) X-H和Y—H属于极性共价键,其中极性较强的键是______(X、Y用元素符号表示)。X的第一电离能比Y的______(填“大”或“小“)。
(3) 写出X单质与Z的最高价氧化物对应的水化物的浓溶液反应的化学方程式____________________________________________________________
(4)W的基态原子的外围电子排布式是____________。
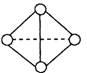
(5) 已知一种分子Y4分子结构如上图所示:断裂1molY—Y吸收167KJ的热量,生成1molY Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___
Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___ _____________________
_____________________
(1) 常温常压下Z单质是_______晶体(填类型),微粒间通过______形成晶体(填微粒间相互作用的类型)。Y2分子中存在
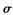 键和
键和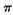 键个数之比为____________。
键个数之比为____________。(2) X-H和Y—H属于极性共价键,其中极性较强的键是______(X、Y用元素符号表示)。X的第一电离能比Y的______(填“大”或“小“)。
(3) 写出X单质与Z的最高价氧化物对应的水化物的浓溶液反应的化学方程式____________________________________________________________
(4)W的基态原子的外围电子排布式是____________。

(5) 已知一种分子Y4分子结构如上图所示:断裂1molY—Y吸收167KJ的热量,生成1molY
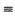 Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___
Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___ _____________________
_____________________(14分)


略

练习册系列答案
相关题目
 数与电子层数相同。最高价氧化物与强酸反应的离子方程式为________________________________(2分),最高价氧化物对应水化物与氢氧化钾反应的化学方程式为 _________________________________________(2分)。
数与电子层数相同。最高价氧化物与强酸反应的离子方程式为________________________________(2分),最高价氧化物对应水化物与氢氧化钾反应的化学方程式为 _________________________________________(2分)。 件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。 ___________。
___________。 件下)。A、C、E都为氢化物,三者中C的相对分子质量最小;A、C具有相同的电子数;D、E、F都为氧化物,且D、F皆为有毒气体。则:
件下)。A、C、E都为氢化物,三者中C的相对分子质量最小;A、C具有相同的电子数;D、E、F都为氧化物,且D、F皆为有毒气体。则: