题目内容
(5分)不同元素的气态原子失去最外层一个电子所需要的能量(设为E)如下表所示。试根据元素在元素周期表中的位置,分析表中的数据的变化特点,并回答下列问题:
(1)同主族内不同元素的E值变化的特点是_______________________;各主族中E值的这种变化的特点体现了元素性质的 _______变化规律。
(2)同周期内,随着原子序数的递增,E值增大,但个别元素的E值出现反常现象。试预测下列关系正确的是 ___(填序号)。
① E(As)> E(Se) ② E(As)< E(Se) ③ E(Br)> E(Se) ④ E(Br) < E(Se)
(3)第10号元素E值较大的原因是 _________;
(4)第7号元素和第8号元素的E值出现反常的原因_________________________。
| 原子序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| E/eV | 13.4 | 24.6 | 5.4 | 9.3 | 8.3 | 11.3 | 14.5 | 13.6 | 17.4 | 21.6 |
| 原子序数 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| E/eV | 5.1 | 7.6 | 6.0 | 8.1 | 11.0 | 10.4 | 13.0 | 15.8 | 4.3 | |
(2)同周期内,随着原子序数的递增,E值增大,但个别元素的E值出现反常现象。试预测下列关系正确的是 ___(填序号)。
① E(As)> E(Se) ② E(As)< E(Se) ③ E(Br)> E(Se) ④ E(Br) < E(Se)
(3)第10号元素E值较大的原因是 _________;
(4)第7号元素和第8号元素的E值出现反常的原因_________________________。

 (5分)(1)同一主族,随着原子序数增大,E值变小 周期性
(5分)(1)同一主族,随着原子序数增大,E值变小 周期性(2) 1、3
(3)10号元素是Ne,它的原子最外层已经形成8电子稳定结构
(4)第7号元素和第8号元素分别是N和O,由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的。
(1)根据表中数据可知,同一主族,随着原子序数增大,E值是逐渐变小的,这说明各主族中E值的这种变化的特点体现了元素性质的周期性变化规律。
(2)根据表中数据可知,氮元素的大于氧元素的,P元素的大于S元素的。这是由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的。由于As元素的4p轨道电子处于半充满状态,稳定性强,所以第一电离能大于Se元素的,即1正确;由于溴元素的非金属性强于Se的,所以选项3也是正确的,答案选1和3。
(3)10号元素是Ne,它的原子最外层已经形成8电子稳定结构,所以第一电离能大。
(4)第7号元素和第8号元素分别是N和O,由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的。
(2)根据表中数据可知,氮元素的大于氧元素的,P元素的大于S元素的。这是由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的。由于As元素的4p轨道电子处于半充满状态,稳定性强,所以第一电离能大于Se元素的,即1正确;由于溴元素的非金属性强于Se的,所以选项3也是正确的,答案选1和3。
(3)10号元素是Ne,它的原子最外层已经形成8电子稳定结构,所以第一电离能大。
(4)第7号元素和第8号元素分别是N和O,由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

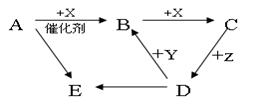
 如下:
如下: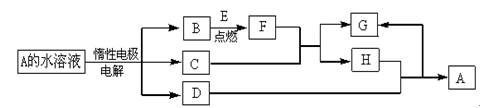
 键和
键和 键个数之比为____________。
键个数之比为____________。
 Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___
Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___ _____________________
_____________________