��Ŀ����
����Ŀ����Li��ʯī�ĸ��ϲ����Լ�����Fe2O3�������缫������ӵ�أ���ѭ����ŵ�����п�ʵ�ֶԴ��ԵĿ������(��ͼ)�������й�˵��һ���������
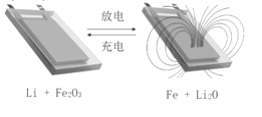
A. �õ�صĵ������Һ������������Һ
B. �ŵ�ʱ���ܷ�Ӧʽ��6Li+Fe2O3=3Li2O+2Fe
C. ���ʱ�������ĵ缫��Ӧ��2Fe+3Li2O-6e-= Fe2O3+6Li+
D. ��ŵ�����У���ؿ��ڱ�����������������֮��ѭ������
���𰸡�A
��������
A.��Ϊ�õ���к���Li��Fe2O3�������������ᷴӦ����A����
B.�ŵ�ʱ��Li��Ϊ������ʧ���ӱ�����������Fe2O3�õ��ӱ���ԭ���ʷŵ�ʱ���ܷ�Ӧʽ��6Li+Fe2O3=3Li2O+2Fe����B��ȷ��
C.���ʱ�������������෴�������ĵ缫��Ӧ��2Fe+3Li2O-6e-= Fe2O3+6Li+����C��ȷ��
D.������Ŀ��ʾ��ͼ���������Ǵ�������Ĺ��̣����Կ������û�б�������������Ϊ�����̵�����ת����������Fe��Li2Oת��ΪLi��Fe2O3����˳��ʱ��ز��ܱ������������ŵ���̵�����ת������Li��Fe2O3ת��ΪFe��Li2O���������ɣ���˷ŵ�ʱ��ر�������������D��ȷ��
��ѡA��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����ǻ�ѧʵ���Ҽ����������е���Ҫ���ʣ�Ӧ�ù㷺��N2(g)��3H2(g)![]() 2NH3(g) ��H=-92.2kJ/mol
2NH3(g) ��H=-92.2kJ/mol
��1���ں��º����ܱ������н��кϳɰ���Ӧ����ʼͶ��ʱ������Ũ�����±���
N2 | H2 | NH3 | |
Ͷ�Ϣ� | 1.0 mol/L | 3.0 mol /L | 0 |
Ͷ�Ϣ� | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
�ٰ�Ͷ�Ϣ���з�Ӧ����ôﵽ��ѧƽ��״̬ʱH2��ת����Ϊ40%������¶��ºϳɰ���Ӧ��ƽ�ⳣ������ʽΪ_____________��
�ڰ�Ͷ�Ϣ���з�Ӧ����ʼʱ��Ӧ���еķ���Ϊ________�������������
���������¶ȣ���ϳɰ���Ӧ�Ļ�ѧƽ�ⳣ��________����������С�����䡱����
��2��L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ���ϳɰ���Ӧ��H2(g)��ƽ��ת������X�ı仯��ϵ��

�� X��������������______��
�� �ж�L1��L2�Ĵ�С��ϵ�����������ɣ�______��
��3���绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ��ʾ��ͼ���£�

�� �缫b�Ϸ�������______��Ӧ�����������ԭ����
�� д���缫a�ĵ缫��Ӧʽ��_________��