题目内容
【题目】实验室常用浓盐酸与高锰酸钾发生反应快速制备氯气。化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用单线桥法表示该反应过程中的电子转移情况。________________,该反应中HCl被氧化和未被氧化的物质的量之比为________。
(2)下列装置为实验室制备氯气的装置。
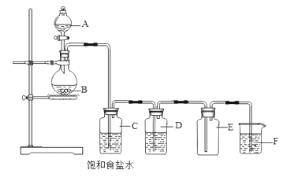
装置C的作用是______________________,装置E的作用是_______________________________。装置F中的试剂是_________________。
(3)写出F中发生的离子反应方程式________________________________________________________。
【答案】 5:3 除HCl 收集氯气 NaOH溶液/KOH溶液 2OH-+Cl2=Cl-+ClO-+H2O
5:3 除HCl 收集氯气 NaOH溶液/KOH溶液 2OH-+Cl2=Cl-+ClO-+H2O
【解析】
(1)2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O反应中,KMnO4→MnCl2,锰元素由+7价降低到+2价,得到电子5e-,所以2KMnO4→2MnCl2共转移电子去10e-;16molHCl(浓),其中10molHCl发生氧化反应生成5molCl2,6molHCl起到酸的作用,没有被氧化,据此计算该反应中HCl被氧化和未被氧化的物质的量之比;
(2)(3)实验室用二氧化锰与浓盐酸加热反应生成的氯气中含有氯化氢和水蒸气,因此用饱和食盐水除去氯化氢,用浓硫酸吸收水蒸气,用向上排空气法收集氯气(氯气的密度大于空气),氯气有毒,可以用氢氧化钠溶液或氢氧化钾溶液吸收尾气;据以上分析进行解答。
(1)2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O反应中,KMnO4→MnCl2,锰元素由+7价降低到+2价,得到电子5e-,所以2KMnO4→2MnCl2共转移电子去10e-;用单线桥法表示该反应过程中的电子转移情况如下: ;16molHCl(浓),其中10molHCl发生氧化反应生成5molCl2,6molHCl起到酸的作用,没有被氧化,所以该反应中HCl被氧化和未被氧化的物质的量之比为10:6=5:3;
;16molHCl(浓),其中10molHCl发生氧化反应生成5molCl2,6molHCl起到酸的作用,没有被氧化,所以该反应中HCl被氧化和未被氧化的物质的量之比为10:6=5:3;
故答案是: ;5:3;
;5:3;
(2)实验室用二氧化锰与浓盐酸加热反应生成的氯气中含有氯化氢和水蒸气,因此用饱和食盐水除去氯化氢,装置D中盛有浓硫酸,吸收水蒸气,装置E的作用是收集氯气(氯气的密度大于空气),氯气有毒,可以用氢氧化钠溶液或氢氧化钾溶液吸收尾气;所以装置C的作用是除HCl;装置E的作用是收集氯气;装置F中的试剂是NaOH溶液/KOH溶液;
故答案是:除HCl;收集氯气;NaOH溶液/KOH溶液;
(3)装置F中的试剂是NaOH溶液/KOH溶液,吸收多余的氯气,离子反应方程式:2OH-+Cl2=Cl-+ClO-+H2O;
故答案是:2OH-+Cl2=Cl-+ClO-+H2O。