题目内容
【题目】将![]() 绿矾
绿矾![]() 样品进行加热,其热重曲线
样品进行加热,其热重曲线![]() 样品质量随温度变化的曲线
样品质量随温度变化的曲线![]() 如图所示。下列说法正确的是
如图所示。下列说法正确的是![]()
![]()

A.![]() 时,获得的固体产物为
时,获得的固体产物为![]()
B.![]() 时,反应的化学方程式为
时,反应的化学方程式为![]()
C.Q段获得的固态产物具有磁性
D.Q段获得的气态产物只有![]()
【答案】A
【解析】
8.34g FeSO47H2O样品物质的量=![]() =0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,结合质量的变化可确定在不同温度时加热后固体的化学式,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n(FeSO47H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=
=0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,结合质量的变化可确定在不同温度时加热后固体的化学式,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n(FeSO47H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=![]() =0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,以此解答该题。
=0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,以此解答该题。
A、样品的物质的量![]() ,
,![]() 时失去结晶水的物质的量
时失去结晶水的物质的量![]() ,则
,则![]() 失去
失去![]() 结晶水,
结晶水,![]() 时固态产物为
时固态产物为![]() ,A正确;
,A正确;
B、按照同样的计算方法可知,N段和P段的固态产物分别为![]() 和
和![]() ,则
,则![]() 时,反应的化学方程式为
时,反应的化学方程式为![]() ,B错误;
,B错误;
C、Q段固态产物中含有![]() ,则
,则![]() ,该物质为
,该物质为![]() ,C错误;
,C错误;
D、根据质量守恒定律以及C项的计算可知此时气态产物不可能只有![]() ,D错误。
,D错误。
故选A。

【题目】汽车发动机中生成NO的反应为:![]() ,
,![]() 时该反应的化学平衡常数
时该反应的化学平衡常数![]() 。在
。在![]() 下甲、乙、丙三个恒容密闭容器中,投入
下甲、乙、丙三个恒容密闭容器中,投入![]() 和
和![]() 模拟反应,起始浓度如下表所示。下列判断不正确的是.
模拟反应,起始浓度如下表所示。下列判断不正确的是.
起始浓度 | 甲 | 乙 | 丙 |
|
|
|
|
|
|
|
|
A.起始时,反应速率:丙![]() 甲
甲![]() 乙
乙
B.平衡时,![]() :甲
:甲![]() 丙
丙![]() 乙
乙
C.平衡时,![]() 的转化率:甲
的转化率:甲![]() 乙
乙
D.平衡时,甲中![]()
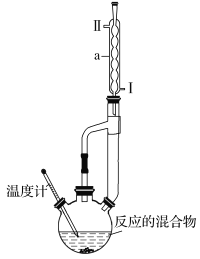
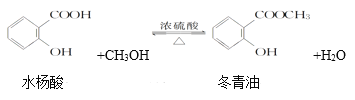
【题目】冬青油是一种无色液体,某实验小组利用如图所示的装置制备冬青油。化学反应原理和实验装置如下所示:
产物的有关数据如表所示:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
实验步骤如下所示:
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀。
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h。
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL5%碳酸氢钠溶液和30 mL水洗涤。
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙。
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g。
请回答下列问题:
(1)本实验中浓硫酸的作用是___。
(2)装置中仪器a的名称是___,进水口为___(填“Ⅰ”或“Ⅱ”)。温度计的适宜规格为___(填代号)。
①50℃ ②100℃ ③300℃
(3)用碳酸氢钠溶液洗涤的目的是___;用水洗涤时,产品在___(填“上”或“下”)层。
(4)加入无水氯化钙的目的是____。
(5)本次实验中冬青油的产率为___。





