题目内容
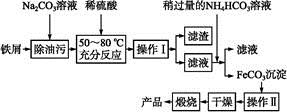
工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
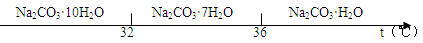
回答下列问题:
(1)溶解时通入热空气的作用有 (写出两条即可);生成氢氧化镁沉淀的离子方程式为 。
(2)“趁热过滤”时的温度应控制在 ;简述过滤后洗涤固体的操作 。
(3)为检验母液中是否含有Cl-,必须加入的试剂为 。
(4)实验室进行“灼烧”的陶瓷仪器有 。
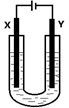
(5)室温下用石墨电极电解饱和Na2CO3溶液(装置如图),写出Y电极反应式: ;一段时间后X电极可收集到的气体一定有 ,可能有 。

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
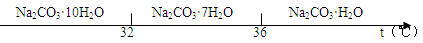
回答下列问题:
(1)溶解时通入热空气的作用有 (写出两条即可);生成氢氧化镁沉淀的离子方程式为 。
(2)“趁热过滤”时的温度应控制在 ;简述过滤后洗涤固体的操作 。
(3)为检验母液中是否含有Cl-,必须加入的试剂为 。
(4)实验室进行“灼烧”的陶瓷仪器有 。
(5)室温下用石墨电极电解饱和Na2CO3溶液(装置如图),写出Y电极反应式: ;一段时间后X电极可收集到的气体一定有 ,可能有 。

(1)升温加快溶解速率、除去铁元素【或加热促进Fe3+(Fe2+)的水解或氧化Fe2+】(2分);Mg2+ +2OH-=" Mg" (OH) 2↓(或MgCO3 +2OH-=" Mg" (OH) 2+CO32-) (2分)
(2)不低于36℃(2分);
向过滤器中加入36℃的热水没过固体表面,待水自然流干后,重复操作2~3次(2分)
(3)足量的Ba(NO3)2和HNO3溶液(1分)、少量的AgNO3溶液(1分)
(4)坩埚、泥三角(2分)(答酒精灯不倒扣分,其余答错一个倒扣1分,直到本小问0分)
(5)2H+ +2e- =H2↑(或2H2O+2e- = H2↑+2OH-,2分);O2;CO2(写名称也给分,各1分,共2分)
(2)不低于36℃(2分);
向过滤器中加入36℃的热水没过固体表面,待水自然流干后,重复操作2~3次(2分)
(3)足量的Ba(NO3)2和HNO3溶液(1分)、少量的AgNO3溶液(1分)
(4)坩埚、泥三角(2分)(答酒精灯不倒扣分,其余答错一个倒扣1分,直到本小问0分)
(5)2H+ +2e- =H2↑(或2H2O+2e- = H2↑+2OH-,2分);O2;CO2(写名称也给分,各1分,共2分)
试题分析:(1)溶解时通入热空气可以加快溶解速率,同时可以氧化亚铁离子为铁离子,方便除去铁元素;镁离子与氢氧根离子结合生成氢氧化镁沉淀,离子方程式为Mg2+ +2OH-=" Mg" (OH) 2↓;
(2)碳酸钠的饱和溶液在不同温度下析出不同的溶质,据图可知,低于36℃时会生成Na2CO3·7H2O等,所以“趁热过滤”时的温度应控制在不能低于36℃;过滤后洗涤固体时不同于一般的洗涤,仍要注意蒸馏水的温度不能低于36℃,所以正确操作是向过滤器中加入36℃的热水没过固体表面,待水自然流干后,重复操作2~3次;
(3)因为溶液中存在SO42-,对Cl-的检验带来干扰,所以在检验Cl-前先除去SO42-,所用试剂是足量的Ba(NO3)2和HNO3溶液,然后在加入硝酸银溶液,观察现象,进行判断;
(4)坩埚有不同的类型,实验室进行“灼烧”的陶瓷仪器有瓷坩埚、泥三角;
(5)Y极是阴极,阳离子放电发生还原反应,电极反应式为2H2O+2e- = H2↑+2OH-,X极为阳极,氢氧根离子放电生成氧气,所以X极产生的气体一定有氧气,X极氢氧根离子放电,导致氢离子浓度增大,所以溶液中的碳酸根离子与氢离子反应会生成二氧化碳气体,因此气体中还可能含有二氧化碳。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目