题目内容
1.有两种气态烃的混合物1L,完全燃烧可得同温同压下的3.8L二氧化碳和3.6L水蒸气,这两种烃可能是( )| A. | C2H4、C4H6 | B. | C2H2、C4H6 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
分析 两种气态烃的混合物共1L,在空气中完全燃烧得到3.8L CO2、3.6L水蒸气,根据相同体积下气体的体积之比等于物质的量之比,可计算出平均分子式为C3.8H7.2,利用平均值法对各选项进行判断.
解答 解:两种气态烃的混合物共1L,在空气中完全燃烧得到3.8L CO2、3.6L水蒸气,
相同体积下气体的体积之比等于物质的量之比,
结合质量守恒定律可得该混合气体的平均分子式为:C3.8H7.2,
由于A、B、D中各种烃分子中的H原子数都小于7.2,不可能平均氢原子数为7.2,故A、B、D错误,
C.C3H4、C4H8:设分别为xmol、为ymol,若平均碳原子数为3.8,则:$\frac{3x+4y}{x+y}$=3.8,整理可得:x:y=1:4;若平均H原子数为7.2时,则:$\frac{4x+8y}{x+y}$=7.2,整理可得:x:y=1:4,符号条件,故C正确;
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握平均分子式、质量守恒在确定有机物分子式中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
11.下列化学用语书写正确的是( )
| A. | 氯离子的结构示意图: | |
| B. | CCl4的电子式: | |
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| D. | 用电子式表示氯化氢分子的形成过程:H+ → → |
12.下列叙述正确的是( )
| A. | CHF=CHCl存在顺反异构 | |
| B. | 结构不同,性质相同,化学式相同的物质互称同分异构体 | |
| C. |  和 和 均是芳香烃, 均是芳香烃,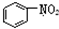 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
9.在2A(g)+B(g)═3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | vA=0.5mol•L-1•s-1 | B. | vB=0.3 mol•L-1•s-1 | ||
| C. | vC=0.8 mol•L-1•s-1 | D. | vD=1.0 mol•L-1•s-1 |
16.如图是某有机物分子的简易球棍模型.下列关于该有机物的说法中错误的是( )


| A. | 分子式为C3H7O2N | |
| B. | 该有机物能发生缩聚反应 | |
| C. | 能通过聚合反应生成高分子化合物 | |
| D. | 具有相同官能团的该有机物的同分异构体还有两种 |
6.613C可用于含碳化合物的结构分析,613C表示的是( )
| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数是13,原子序数是6,核内有7个质子 | |
| D. | 质量数是13,原子序数是6,核内有7个中子 |
13.已知化合物NH5的结构和NH4Cl相似,下列关于NH5的下列说法中正确的是( )
| A. | NH5是共价化合物 | |
| B. | NH5的电子式为NH4+[:H]- | |
| C. | NH5中氢元素呈价+1和-1价 | |
| D. | NH5与水发生氧化还原反应,置换出氢气 |
10.在N2+3H2?2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4mol/L,则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
| A. | 0.3mol/(L•s) | B. | 0.4 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
11.下列关于原电池的说法正确的是( )
| A. | 把光能转变成了化学能 | B. | 把化学能转化成了光能 | ||
| C. | 把热能转变成了电能 | D. | 把化学能转化成了电能 |