题目内容
10.在N2+3H2?2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4mol/L,则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )| A. | 0.3mol/(L•s) | B. | 0.4 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
分析 根据v=$\frac{△c}{△t}$计算v(NH3),再根据速率之比等于化学计量数之比计算v(H2).
解答 解:反应开始至2s末,氨的浓度由0变为0.4mol•L-1,
所以v(NH3)=$\frac{0.4mol/L}{2s}$=0.2mol/(L•s),
速率之比等于化学计量数之比,
所以v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×0.2mol/(L•s)=0.3mol/(L•s),
故选A.
点评 本题考查化学反应速率的计算,难度较小,考查学生对基础的理解,反应速率计算可用定义法或化学计量数法,根据情况选择计算方法.

练习册系列答案
相关题目
1.有两种气态烃的混合物1L,完全燃烧可得同温同压下的3.8L二氧化碳和3.6L水蒸气,这两种烃可能是( )
| A. | C2H4、C4H6 | B. | C2H2、C4H6 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
5.如图,下列装置能产生有效电流的是( )
| A. | 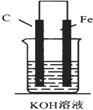 | B. | 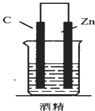 | C. | 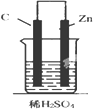 | D. |  |
15.下列反应可能属于吸热反应的是( )
| A. | 燃烧反应 | B. | Mg与醋酸溶液的反应 | ||
| C. | 中和反应 | D. | Ba(OH)2•8H2O与NH4Cl |
19.下列微粒结构示意图表示的元素为第IA的是( )
| A. | 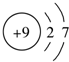 | B. | 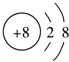 | C. | 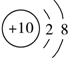 | D. | 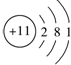 |
20.在pH=a的某电解质溶液中插入两支惰性电极,电解一段时间后,溶液pH<a,则电解质是( )
| A. | Na2SO4 | B. | KCl | C. | NaOH | D. | CuSO4 |

 ,把它溶于水,由于共价键受到破坏而电离出H+和Q-,使溶液呈酸性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)H2O>H2S.
,把它溶于水,由于共价键受到破坏而电离出H+和Q-,使溶液呈酸性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)H2O>H2S.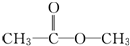
 或
或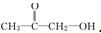 (写出结构简式).
(写出结构简式).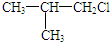 化合物有三个峰,而化合物CH3CH=CHCl却得到氢原子给出的6个信号峰.根据原子在空间的排列方式的不同,写出CH3CH=CHCl 分子的空间异构体:
化合物有三个峰,而化合物CH3CH=CHCl却得到氢原子给出的6个信号峰.根据原子在空间的排列方式的不同,写出CH3CH=CHCl 分子的空间异构体: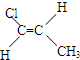
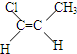 .
.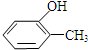 ,
, ,
,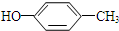 ,对应在PMR谱上观察到氢原子所给出的峰的情况及比例:1:1:1:1:1:3;1:1:1:1:1:3;1:2:2:3.
,对应在PMR谱上观察到氢原子所给出的峰的情况及比例:1:1:1:1:1:3;1:1:1:1:1:3;1:2:2:3.