题目内容
(12分)已知可逆反应CO + H2O (g) CO2 + H2,在830K温度下达到平衡。
CO2 + H2,在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K= 。
(2)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为______________;K值为______________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(4)若830K时,起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a= ________c。
(1)K= (2)α(H2O) =40% K=1
(2)α(H2O) =40% K=1
(3)α(H2O) =25% (4)①  ,②a = b,则a = 2c
,②a = b,则a = 2c
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K= 。
。
(2)
CO + H2O (g) CO2 + H2
CO2 + H2
起始浓度(mol/L) 2 3 0 0
转化浓度(mol/L) 1.2 1.2 1.2 1.2
平衡浓度(mol/L) 0.8 1.8 1.2 1.2
所以平衡时水蒸气的转化率为
平衡常数K=
(3)
CO + H2O (g) CO2 + H2
CO2 + H2
起始浓度(mol/L) 2 6 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) (2-x)(6-x) x x
所以K=
解得x=1.5mol/L
所以水蒸气的转化率是
(4)①
CO + H2O (g) CO2 + H2
CO2 + H2
起始浓度(mol/L) a b 0 0
转化浓度(mol/L) c c c c
平衡浓度(mol/L) (a-c) (b-c) c c
所以根据平衡常数的表达式可知
②根据①中关系式可知,当a = b时,a=2c
考点:考查平衡常数的有关由于、转化率的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题,试题贴近高考,注重基础和能力的双向考查,有利于培养学生分析问题、解决问题的能力。该题难易适中,学生不难得分。

 CO2+H2,达到平衡时,
CO2+H2,达到平衡时, CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K=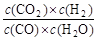 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。 CO2 + H2,达到平衡时,
CO2 + H2,达到平衡时, CO2(g) + H2(g),
CO2(g) + H2(g),