题目内容
已知可逆反应CO+H2O(g)?CO2+H2,在一定条件下达到平衡状态.
(1)T℃时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,此时平衡常数K值为
(2)T℃时,若起始时:c(CO)=2mol/L,c(H2O)=6mol/L,则水蒸气的转化率为
(3)若T℃时,起始浓度c(CO)=amol/L,c(H2O)=bmol/L,平衡时H2的浓度c(H2)=cmol/L,则a、b、c之间的关系式是
(1)T℃时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,此时平衡常数K值为
1
1
;水蒸气的转化率为40%
40%
.(2)T℃时,若起始时:c(CO)=2mol/L,c(H2O)=6mol/L,则水蒸气的转化率为
25%
25%
(3)若T℃时,起始浓度c(CO)=amol/L,c(H2O)=bmol/L,平衡时H2的浓度c(H2)=cmol/L,则a、b、c之间的关系式是
ab=ac+bc
ab=ac+bc
.分析:(1)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
水蒸气转化率=
×100%;
(2)温度不变,化学平衡常数不变,根据化学平衡常数求出反应掉的水蒸气的物质的量浓度,再根据转化率公式计算水蒸气的转化率.
(3)温度不变,化学平衡常数不变,利用三段式法结合平衡常数计算a、b、c之间的关系式.
水蒸气转化率=
| 水蒸气浓度变化量 |
| 水蒸气的起始浓度 |
(2)温度不变,化学平衡常数不变,根据化学平衡常数求出反应掉的水蒸气的物质的量浓度,再根据转化率公式计算水蒸气的转化率.
(3)温度不变,化学平衡常数不变,利用三段式法结合平衡常数计算a、b、c之间的关系式.
解答:解:(1)平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
=1,
水蒸气的转化率=
=40%;
故答案为:1;40%;
(2)设反应的水蒸气的浓度变化量为xmol/L,则:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 6-x x x
故
=1,解得y=1.5,
所以水蒸气的转化率为
=25%,
故答案为:25%;
(3)CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol/L):a b 0 0
变化(mol/L):c c c c
平衡(mol/L):a-c b-c c c
故
=1,整理得ab=ac+bc;
故答案为:ab=ac+bc.
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
| 1.2×1.2 |
| 0.8×1.8 |
水蒸气的转化率=
| 1.2mol/L |
| 3mol/L |
故答案为:1;40%;
(2)设反应的水蒸气的浓度变化量为xmol/L,则:
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始(mol/L):2 3 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 6-x x x
故
| x×x |
| (2-x)×(6-x) |
所以水蒸气的转化率为
| 1.5mol/L |
| 6mol/L |
故答案为:25%;
(3)CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始(mol/L):a b 0 0
变化(mol/L):c c c c
平衡(mol/L):a-c b-c c c
故
| c×c |
| (a-c)×(b-c) |
故答案为:ab=ac+bc.
点评:本题考查了用三段式法对化学反应进行计算,难度不大,注意化学平衡常数K只与温度有关,与其他物理量无关,注意化学平衡常数的应用.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
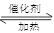 CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为