题目内容
(10分)已知可逆反应CO + H2O(g) CO2 + H2,达到平衡时,
CO2 + H2,达到平衡时,
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的平衡转化率为 ;K值为 。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的平衡转化率为 。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度c (H2) = c mol/L,
①a、b、c之间的关系式是 ②当a = b时,a = c。
(1)40% 1 (2)25% (3)ab=(a+b)c 2.
【解析】(1)CO的转化率为60%,则消耗CO是1.2mol/L,所以消耗水蒸气是1.2mol/L,则水蒸气的转化率是1.2÷3=0.4,即转化率是40%;平衡时生成CO2和氢气都是1.2mol/L,而剩余CO是0.8mol/L,氢气是1.8mol/L,所以平衡常数K=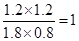 。
。
(2)设水蒸气的转化率是x,则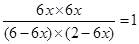 ,解得x=25%。
,解得x=25%。
(3)H2的平衡浓度c (H2) = c
mol/L,则CO2的平衡浓度也是c mol/L,所以有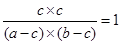 ,解得ab=(a+b)c;如果a=b,则a=2c。
,解得ab=(a+b)c;如果a=b,则a=2c。

(10分)已知A(g)+B(g) 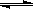 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|
|温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
|
平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1).该反应的平衡常数表达式K= 。
(2).830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, 若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3).1200℃时反应C(g)+D(g) 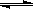 A(g)+B(g)的平衡常数的值为
。
A(g)+B(g)的平衡常数的值为
。
(10分)已知:溴单质(Br2)、化合物与氯的性质相似,溴单质的水溶液呈黄色,溴单质的四氯化碳溶液呈橙红色。在足量的稀氯化亚铁溶液中,加入1~2滴液态溴单质,振荡后溶液变为黄色。
⑴甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是 (填化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是 。
⑵现提供如下试剂:A.酸性高锰酸钾溶液B.氢氧化钠溶液C.四氯化碳D.硫氰化钾溶液实验证明乙同学的推断是正确的,请用三种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂(代号) |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
|
第三种方法 |
|
|
⑶根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 。
 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
 CO2 + H2,达到平衡时,
CO2 + H2,达到平衡时,