题目内容
11.某一化学兴趣小组的同学在家中进行实验,按照图1连接好线路,发现灯泡不亮;按照图2连接好线路,发现灯泡亮了.由此得出的以下结论正确的是( )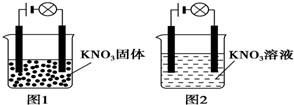
| A. | KNO3不是电解质 | |
| B. | KNO3溶液是电解质 | |
| C. | KNO3在水溶液中电离出了可以自由移动的离子 | |
| D. | 在KNO3溶液中,水电离出了大量的离子 |
分析 A.在水溶液或者熔融状态下能导电的化合物是电解质,据此解答;
B.电解质是化合物,属于纯净物;
C.硝酸钾溶于水时,在水分子的作用下电离出了可以自由移动的离子;
D.水是弱电解质,电离程度微弱.
解答 解:A.硝酸钾固体在溶液水或熔化状态下都能导电,是化合物,属于电解质,故A错误;
B.电解质必须为化合物,而硝酸钾溶液属于混合物,一定不是电解质,故B错误;
C.硝酸钾溶于水时,在水分子的作用下电离出了可以自由移动的离子,故C正确;
D.水为极弱电解质,不可能电离出大量的离子,故D错误;
故选:C.
点评 本题通过实验,考查了电解质的判断和电解质导电的条件,注意电解质必须在一定条件下电离出自由离子才能导电,解题关键把握电解质的概念.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案
相关题目
19.已知室温下某溶液由水电离出的氢离子浓度是10-12mol/L,在此溶液中肯定能大量共存的离子组是( )
| A. | NO3-、NH4+、K+、SO42- | B. | CO32-、Cl-、Na+、K+ | ||
| C. | Mg2+、NO3-、C1-、Fe2+ | D. | K+、Na+、NO3-、SO42- |
6. 物质A~E在水中电离产生下列离子:
物质A~E在水中电离产生下列离子:
常温下将各物质的溶液从1ml稀释到1000ml,PH的变化关系如图所示,期中A和D反应生成E.请回答下列问题
(1)根据PH的变化关系,写出下列物质的化学式:BNaOH DCH3COOH
(2)写出A与C反应的离子方程式NH3+H+=NH4+
(3)25℃时0.1mol/L的NH4Cl溶液的PH=a,则NH4Cl溶液中c(H+)-c(NH3•H2O)=c(OH-)(用含a的关系式表示)
(4)H2SO4的酸式盐NH4HSO4,在NH4HSO4溶液中加入NaOH使溶液呈中性,则溶液中各离子浓度大小顺序为C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-).
 物质A~E在水中电离产生下列离子:
物质A~E在水中电离产生下列离子:| 阳离子 | NH4+ H+ Na+ |
| 阴离子 | OH-CH3COO- SO42- |
(1)根据PH的变化关系,写出下列物质的化学式:BNaOH DCH3COOH
(2)写出A与C反应的离子方程式NH3+H+=NH4+
(3)25℃时0.1mol/L的NH4Cl溶液的PH=a,则NH4Cl溶液中c(H+)-c(NH3•H2O)=c(OH-)(用含a的关系式表示)
(4)H2SO4的酸式盐NH4HSO4,在NH4HSO4溶液中加入NaOH使溶液呈中性,则溶液中各离子浓度大小顺序为C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-).
16.某兴趣小组在实验室进行混合物的提纯操作,请你参与实验,完成下列任务(括号内物质为杂质).
注意:①划线的空不必填写;②发生离子反应的必须写离子方程式.
注意:①划线的空不必填写;②发生离子反应的必须写离子方程式.
| 物质 | 所用试剂 (填化学式) | 主要除杂方法 | 反应方程式 |
| Cu(Zn) | |||
| H2(CO2) | |||
| I2(H2O) | / | ||
| KNO3(NaCl) | / | / | |
| 乙醇(水) | CaO |
3.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O(g)含有的分子数约为NA | |
| B. | 常温常压下,5.85g NaCl含有的Na+离子数为0.1 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 1L物质的量浓度为0.5mol•/L的CH3COOH溶液中,含有CH3COOH个数为0.5NA |
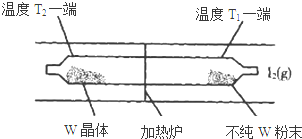 利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0.
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0. ,氧化剂是MnO2还原剂是HCl(填化学式)
,氧化剂是MnO2还原剂是HCl(填化学式)