题目内容
16.某兴趣小组在实验室进行混合物的提纯操作,请你参与实验,完成下列任务(括号内物质为杂质).注意:①划线的空不必填写;②发生离子反应的必须写离子方程式.
| 物质 | 所用试剂 (填化学式) | 主要除杂方法 | 反应方程式 |
| Cu(Zn) | |||
| H2(CO2) | |||
| I2(H2O) | / | ||
| KNO3(NaCl) | / | / | |
| 乙醇(水) | CaO |
分析 Zn为活泼金属,可与盐酸等反应而除去,二氧化碳为酸性气体,可与氢氧化钠溶液反应;碘易溶于有机溶剂,可分别萃取、蒸馏提纯;硝酸钾与氯化钠的溶解度随温度的变化不同,可用重结晶的方法分离;乙醇与水的沸点不同,可用蒸馏的方法分离,以此解答该题.
解答 解:Zn为活泼金属,可与盐酸等反应而除去,反应的方程式为Zn+2H+═Zn2++H2↑或Zn+Cu2+═Zn2++Cu,用过滤的方法除杂;
二氧化碳为酸性气体,可与氢氧化钠溶液反应,反应的方程式为CO2+2OH-═CO32-+H2O,可用洗气的方法分离;
碘易溶于有机溶剂,可分别萃取、蒸馏提纯;
硝酸钾与氯化钠的溶解度随温度的变化不同,可用重结晶的方法分离;
乙醇与水的沸点不同,可用蒸馏的方法分离,因水易与氧化钙反应,蒸馏时可加入适量氧化钙,反应的方程式为CaO+H2O═Ca(OH)2,
故答案为:
| 物质 | 所用试剂 (填化学式) | 主要除杂方法 | 反应方程式 |
| Cu(Zn) | HCl(H2SO4) 或CuSO4 | 过滤 | Zn+2H+═Zn2++H2↑ 或Zn+Cu2+═Zn2++Cu |
| H2(CO2) | NaOH | 洗气 | CO2+2OH-═CO32-+H2O |
| I2(H2O) | CCl4(苯) | 萃取、蒸馏 | |
| KNO3(NaCl) | (重)结晶 | ||
| 乙醇(水) | CaO | 蒸馏 | CaO+H2O═Ca(OH)2 |
点评 本题综合考查物质的分离提纯,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同以及常见实验操作方法,难度不大,注意相关知识的学习和积累.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
6.在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)═2AB3(g)△H<0,相关数据如下表所示:△H<0,相关数据如下表所示:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol A2、3mol B2 | 2mol AB3 | 2mol AB3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时AB3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时AB3的反应速率/mol•L-1•min-1 | v甲 | v乙 | v |
| A. | v甲=v丙 | B. | c乙>c甲 | C. | V甲>V丙 | D. | K乙<K丙 |
7.下列关于1.5mol 氢气的叙述中,正确的是( )
| A. | 质量是 4 g | B. | 体积是 33.6 L | ||
| C. | 电子数是3 | D. | 分子数约为 1.5×6.02×1023 个 |
11.某一化学兴趣小组的同学在家中进行实验,按照图1连接好线路,发现灯泡不亮;按照图2连接好线路,发现灯泡亮了.由此得出的以下结论正确的是( )
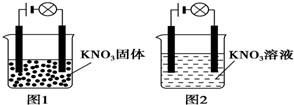

| A. | KNO3不是电解质 | |
| B. | KNO3溶液是电解质 | |
| C. | KNO3在水溶液中电离出了可以自由移动的离子 | |
| D. | 在KNO3溶液中,水电离出了大量的离子 |
1.下列说法正确的是( )
| A. | 某溶液中加入Ba(NO3)2溶液后产生白色沉淀,则原溶液中一定含有SO42- | |
| B. | 某溶液中滴入几滴AgNO3溶液,产生白色沉淀,说明一定是氯化物的溶液 | |
| C. | 将盛满H2的小试管取出,管口向上靠近酒精灯火焰,检验H2纯度 | |
| D. | 将带火星的木条靠近导管口,木条复燃,说明有氧气生成 |
5. 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
(1)下列叙述正确的是AD.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
Mn元素价电子排布式为3d54s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区.
(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为TiO2.
(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O.
②与CNO-互为等电子体微粒的化学式为CO2或N2O或SCN-(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式N≡C-O-H.
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)下列叙述正确的是AD.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区.
(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为TiO2.
(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O.
②与CNO-互为等电子体微粒的化学式为CO2或N2O或SCN-(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式N≡C-O-H.
6.常温下甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,下列推断中正确的是( )
| A. | 甲中由水电离产生的H+的物质的量浓度是乙的10倍 | |
| B. | 物质的量浓度c(甲)=10c(乙) | |
| C. | 中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V (甲) | |
| D. | 甲中的c(OH-)为乙中的c(OH-)的10倍 |
