题目内容
3.T K时,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达到平衡.反应过程中测定的部分数据见表:| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2 s 的平均速率v(CO)=0.080mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=“0.11“mol•L-1,则反应的△H<0 | |
| C. | T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,达到平衡前v正<v逆 | |
| D. | T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80% |
分析 A.根据v(Cl2)=$\frac{△c}{△t}$结合反应速率之比等于化学计量数之比计算v(CO).
B.平衡时c(Cl2)=$\frac{0.20mol}{2.0L}$=0.10mol/L,升高温度,平衡时c(Cl2)=0.11 mol•L-1,说明平衡向正反应方向移动;
C.根据平衡时氯气的物质的量计算各物质的平衡浓度,可计算该温度下的平衡常数,以此判断反应进行的方向;
D.从等效平衡的角度分析.
解答 解:A.反应在前2 s的平均速率v(Cl2)=$\frac{△c}{△t}$=$\frac{\frac{0.16mol}{2.0L}}{2s}$=0.04mol•L-1•s-1,则反应在前2 s的平均速率v(CO)=v(Cl2)=0.04mol•L-1•s-1,故A错误;
B.平衡时c(Cl2)=$\frac{0.20mol}{2.0L}$=0.10mol/L,升高温度,平衡时c(Cl2)=0.11 mol•L-1,说明平衡向正反应方向移动,则正反应应为吸热反应,△H>0,故B错误;
C.COCl2(g)?Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
该温度下k=$\frac{0.1×0.1}{0.4}$=0.025,
若起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,此时Qc=$\frac{0.1×0.1}{0.9}$<0.025,
则反应应向正反应方向移动,反应达到平衡前v正>v逆,故C错误;
D.T K时起始向容器中充入1.0molCl2和1.0molCO,应等效于向2.0L恒容密闭容器中充入1.0mol COCl2,达到平衡时Cl2的转化率等于80%,如加入1.0 mol Cl2和0.9 mol CO,相当于在原来的基础上减小0.1molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率小于80%,故D正确.
故选D.
点评 本题综合考查化学平衡的计算以及等效平衡问题,题目难度较大,注意把握平衡常数的意义及应用.

(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
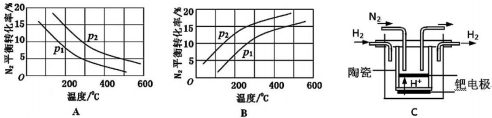
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系р2>р1.
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ.mol-1,2H2(g)+O2(g)?2H2O(l) H=-571.6kJ.mol-1)
| A. | 所含硫原子的物质的量之比为1:1 | B. | 所含硫元素的质量比为5:4 | ||
| C. | 所含氧元素的质量比为4:5 | D. | 所含氧原子的物质的量之比为3:2 |
| A. | 将322 gNa2SO4•10H2O溶于1L水中,所得溶液的物质的量浓度为1 mol•L-1 | |
| B. | 将1L2mol•L-1 H2SO4溶液加水稀释到2L,所得溶液的物质的量浓度为1mol•L-1 | |
| C. | 将1L18.4 mol•L-1的H2SO4溶液加入到1L水中,所得溶液的物质的量浓度为9.2mol•L-1 | |
| D. | 将336mLHCl气体溶于水,配成300mL溶液,所得溶液的物质的量浓度为0.05mol•L-1 |
| A. | 摩尔是表示物质质量的单位 | |
| B. | 摩尔是国际七个基本物理量之一 | |
| C. | 摩尔既是物质的量的单位,又是粒子的数量单位 | |
| D. | 用物质的量时,要指明粒子种类 |
| A. | 0.1mol•L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-) | |
| B. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) | |
| C. | 同浓度的下列溶液中,①NH4HSO4②NH4Cl ③NH3•H2O,c(NH4+)由大到小的顺序是:②>①>③ | |
| D. | 常温下,pH=3的 CH3COOH溶液和pH=11的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
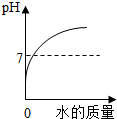 | 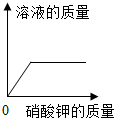 | 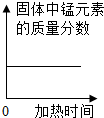 | 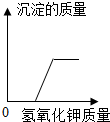 |
| A、向一定量稀盐酸中加水稀释 | B、一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | C、加热一定量的高锰酸钾固体 | D、向盐酸和氯化镁的混合溶液中滴加氢氧化钾溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | $\frac{(b-a)}{a}$×100% | B. | $\frac{168(a-b)}{56a}$×100% | C. | $\frac{84(b-a)}{11a}$×100% | D. | $\frac{106(b-a)}{11a}$×100% |