题目内容
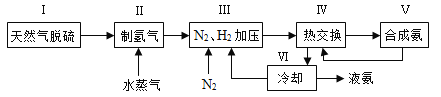
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:____________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
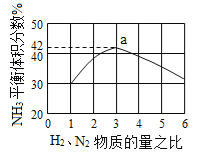
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_____________________。
【答案】
(1)2NH4HS+O2![]() 2NH3·H2O+2S↓(2分)
2NH3·H2O+2S↓(2分)
(2)升高温度(2分)90%(3分)
(3)14.5%(2分)
(4)Ⅳ(1分)对原料气加压;分离液氨后,未反应的N2、H2循环使用(2分)
【解析】
试题分析:(1)H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2![]() 2NH3·H2O+2S↓;
2NH3·H2O+2S↓;
(2)反应①CH4(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+206.4 kJ·mol-1,是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大;反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H2百分含量增大;利用反应②,将CO进一步转化,可提高H2产量,若1mol CO和H2的混合气体(CO的体积分数为20%)中 CO为0.2mol,H2的物质的量为0.8mol,与H2O反应,得到1.18mol CO、CO2和H2的混合气体,依据反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为0.18mol,设转化的一氧化碳的物质的量为x,依据化学平衡三段式列式计算
CO2(g)+3H2(g)△H=+206.4 kJ·mol-1,是气体体积增大的吸热反应,一定可以提高平衡体系中H2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大;反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H2百分含量增大;利用反应②,将CO进一步转化,可提高H2产量,若1mol CO和H2的混合气体(CO的体积分数为20%)中 CO为0.2mol,H2的物质的量为0.8mol,与H2O反应,得到1.18mol CO、CO2和H2的混合气体,依据反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为0.18mol,设转化的一氧化碳的物质的量为x,依据化学平衡三段式列式计算
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2 kJ·mol-1
CO2(g)+H2(g)△H=-41.2 kJ·mol-1
起始量(mol) 0.2 0.18+x 0 0.8
变化量(mol) x x x x
平衡量(mol)0.2-x 0.18 x x+0.8
则0.2-x+x+x+0.8=1.18,则x=0.18。则CO转化率为![]() ×100%=90%;
×100%=90%;
(3)依据反应特征N2+3H2=2NH3,反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为 100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×![]() =35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5﹣21=14.5,则氮气体积分数为14.5%;(4)分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率;
=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5﹣21=14.5,则氮气体积分数为14.5%;(4)分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】

(1)该硫酸的物质的量浓度是____________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需用490 mL 4.6 mol/L的稀硫酸,则要量取该硫酸的体积为_____________mL。
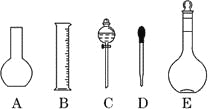
(3)按题(2)的要求配制溶液时,右图中肯定不需要用到的实验仪器是________(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要_______________(填仪器名称)。
(4)在下列配制过程示意图中,有错误的是(填写序号) __________________。
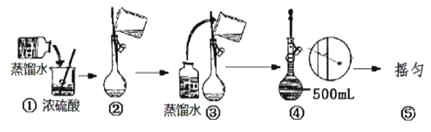
(5)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是 。
A.未经冷却趁热将溶液注入容量瓶中 |
B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 |
D.摇匀后发现液面低于刻度线继续加水定容 |
(6)用配制好的4.6 mol/L的稀硫酸溶液,再来配制50ml 1.4mol/L的H2SO4溶液,需要取配好的溶液_______________ml.