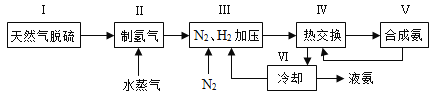
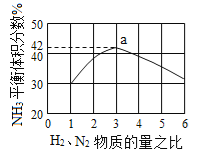
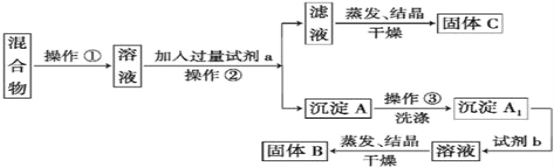
题目内容
【题目】

(1)该硫酸的物质的量浓度是____________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需用490 mL 4.6 mol/L的稀硫酸,则要量取该硫酸的体积为_____________mL。
(3)按题(2)的要求配制溶液时,右图中肯定不需要用到的实验仪器是________(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要_______________(填仪器名称)。

(4)在下列配制过程示意图中,有错误的是(填写序号) __________________。

(5)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是 。
A.未经冷却趁热将溶液注入容量瓶中 |
B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 |
D.摇匀后发现液面低于刻度线继续加水定容 |
(6)用配制好的4.6 mol/L的稀硫酸溶液,再来配制50ml 1.4mol/L的H2SO4溶液,需要取配好的溶液_______________ml.
【答案】(1)18.4;(2)125.0 ; (3) AC;500mL容量瓶;(4) ①④;(5) A;(6)15.2
【解析】试题分析:(1)c=![]() =
=![]() ="18.4" mol/L,故答案为:18.4;
="18.4" mol/L,故答案为:18.4;
(2)需用490 mL 4.6 mol/L的稀硫酸,应该配制500mL,量取该硫酸的体积=![]() =0.125L=125mL,故答案为:125;
=0.125L=125mL,故答案为:125;
(3) 配制一定物质的量浓度的溶液步骤有:计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀。需要的仪器有量筒、烧杯、玻璃棒和胶头滴管500mL容量瓶,不需要烧瓶和分液漏斗,故答案为:AC;500mL容量瓶;
(4)①稀释浓硫酸应该“酸入水”,错误;②转移溶液进入容量瓶,用玻璃棒引流,正确;③定容时引着玻璃棒注入水,正确;④定容时视线应该水平,错误;错误的是①④,故答案为:①④;
(5)A.未经冷却趁热将溶液注入容量瓶中,导致溶液的体积偏小,浓度偏高,正确;B.容量瓶洗涤后,未经干燥处理,对溶质的物质的量和溶液的体积均无影响,对结果无影响,错误;C.定容时仰视观察液面,导致溶液的体积偏大,浓度偏低,错误;D.摇匀后发现液面低于刻度线继续加水定容,导致溶液的体积偏大,浓度偏低,错误;故选A。
(6)根据稀释前后硫酸的物质的量不变,需要4.6 mol/L的稀硫酸溶液的体积=![]() =0.0152L=15.2mL,故答案为:15.2。
=0.0152L=15.2mL,故答案为:15.2。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案