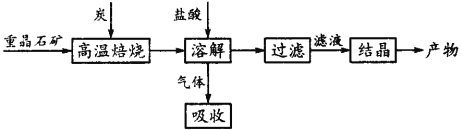
题目内容
【题目】铁、锌、镍、铬及其合金在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________,基态铁原子有_________种不同运动状态的电子。
(2)镍可与CO形成配合物Ni(CO)n,CO分子中σ键与π键的个数比为________;该配合物中原子Ni的价层电子总数为18,则n=________,该配合物的熔点是170℃,则Ni(CO)n 属于__________
(3)在铬的摧化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______,乙醛分子中H—C=O的键角_______(填“大于”、“等于”或“小于”)乙醇分子中的H—C—O的键角。乙醇和乙醛均极易溶于水,其主要原因是_______________。
(4)立方NiO晶体结构类似于NaCl,则Ni2+填入O2-构成的________空隙(填“正四面体”、“正八面体”、“立方体”或“压扁八面体”)。其晶胞边长为ɑ pm,列式表示NiO晶体的密度为____g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)
【答案】 第四周期Ⅶ族 26 1:2 4 分子 sp2和sp3 大于 乙醛、乙醇均能与水形成分子间氢键 正八面体 ![]() ×1030g/cm3或
×1030g/cm3或![]() ×1032 g/cm3
×1032 g/cm3
【解析】(1)铁的原子序数是26,在元素周期表中的位置是第四周期Ⅶ族,基态铁原子核外电子数是26,则有26种不同运动状态的电子。(2)CO分子的结构类似于氮气,则分子中σ键与π键的个数比为 1:2;中心原子是Ni原子,其价电子数是10,每个配体提供的电子数是2,10+2n=18,n=4,该配合物的熔点是170℃,则Ni(CO)n 属于分子晶体;(3)乙醛分子中甲基碳原子全部形成单键,是sp3杂化。醛基中碳原子形成碳氧双键,其杂化方式是sp2杂化。醛基中C原子形成3个σ键,为sp2杂化,是平面三角形结构,键角为120°,乙醇分子内碳原子形成4个σ键,无孤电子对,杂化方式为sp3杂化,是四面体结构,O-C-H键角约为109°28′,键角小于120°,所以乙醛分子中H—C=O的键角大于乙醇分子中的H—C—O的键角。乙醛、乙醇均能与水形成分子间氢键,乙醇乙醇和乙醛均极易溶于水。(4)根据氯化钠的鉴别结构可判断Ni2+填入O2-构成的正八面体中。晶胞中氧离子个数是4,晶胞体积是(a×10-10)3cm3,所以密度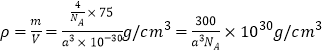 。
。