题目内容
【题目】工业上制备BaCl2的工艺流程图如图:
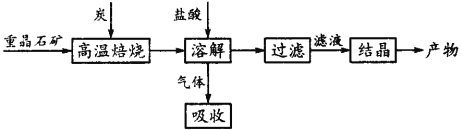
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s)![]() 4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
BaSO4(s)+2C(s)![]() 2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
(1)气体用过量的NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() ________________。
________________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) ![]() 2CO(g)的ΔH=____________kJ·mol-1。
2CO(g)的ΔH=____________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
【答案】(1)S2-+H2O![]() HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O![]() H2S+OH-(可不写);
H2S+OH-(可不写);
(2)2.7×10-3;(3)+172.5;(4)使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需的高温。
【解析】
试题分析:(1)Na2S属于强碱弱酸盐,S2-属于多元弱酸根,要分步水解,其水解方程式为:S2-+H2O![]() HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O![]() H2S+OH-;(2)c(Br-)/c(Cl-)=c(Br-)×c(Ag+)/[c(Cl-)×c(Ag+)]=Ksp(AgBr)·K-1sp(AgCl)=5.4×10-13/2×10-10=2.7×10-3;(3)(①-②)/2得出△H=(571.2-226.2)/2kJ·mol-1=+172.5kJ·mol-1;(4) 使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需的高温。
H2S+OH-;(2)c(Br-)/c(Cl-)=c(Br-)×c(Ag+)/[c(Cl-)×c(Ag+)]=Ksp(AgBr)·K-1sp(AgCl)=5.4×10-13/2×10-10=2.7×10-3;(3)(①-②)/2得出△H=(571.2-226.2)/2kJ·mol-1=+172.5kJ·mol-1;(4) 使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需的高温。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面。查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如下:

(1)操作①的名称是____________,操作②的名称是___________。
(2)反应器Ⅰ中发生反应的化学方程式为________________________。
(3)反应器Ⅱ中发生反应的离子方程式为__________________________。
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为___________。
(5)若想得到201kg的HClO4纯品,至少需要NaClO3_________kg。
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)______________________________。


