题目内容
【题目】某实验小组设计了如下图装置,不断改变A中溶液成份反应以探究SO2气体的性质
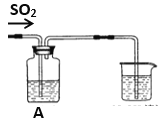
(1)如果A中盛有氢硫酸溶液,通入SO2气体后可观察到有浅黄色浑浊出现,则证明SO2有_________性;写出化学反应方程式____________________________________
(2)如果A中盛有酸性高锰酸钾溶液,通入SO2气体后实验现象是________________,证明SO2有_______性。
(3)如果A中盛有稀硝酸钡溶液, 通入SO2气体后可观察到出现白色沉淀,有无色NO气体生成,写出离子反应方程式_______________________________________________。
(4)如果A中盛有氯化钡溶液,通入SO2气体后本应无沉淀生成,但同学们发现在溶液中也有少量白色沉淀。甲同学把此白色沉淀过滤出来,该沉淀不溶于盐酸。该同学猜测是由于装置中空气没有排净,参与了反应,试写出离子反应方程式_____________________________________。
(5)如果A中盛有纯碱水溶液,写出向A中缓缓加入少量SO2的离子反应方程式____________________________________
【答案】 氧化性 2H2S +SO2=3S↓+2H2O 紫红色溶液褪色 还原性 3Ba2++3SO2+2NO3-+2H2O=2NO+3BaSO4↓+4H+ 2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+ SO2+H2O+2CO32-=SO32-+2HCO3-
【解析】考查实验方案设计的评价以及二氧化硫的化学性质,(1)有淡黄色沉淀产生,即生成S单质,发生的反应是2H2S+SO2=3S↓+2H2O,SO2中S的价态降低,因此SO2作氧化剂,即体现SO2的氧化性;(2)酸性高锰酸钾具有强氧化性,SO2中S显+4价,处于中间价态,既具有氧化性又具有还原性,因此SO2通入酸性高锰酸钾溶液中,紫红色褪去,体现SO2的还原性;(3)NO3-在酸性条件下具有强氧化性,能把SO2氧化成SO42-,本身被还原成NO,然后SO42-与Ba2+结合生成BaSO4沉淀,即离子方程式为3Ba2++3SO2+2NO3-+2H2O=2NO+3BaSO4↓+4H+;(4)白色沉淀不溶于盐酸,白色沉淀是BaSO4,因此反应式为Ba2++SO2+O2→BaSO4↓,SO2中S的价态由+4价→+6价,化合价升高2价,O2中O的化合价降低2价,共降低4价,最小公倍数为4,然后配平其他,即离子反应方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+ ;(5) 亚硫酸的酸性强于碳酸,因为通入SO2是少量,因此离子反应方程式为SO2+H2O+2CO32-=SO32-+2HCO3-。

 高中必刷题系列答案
高中必刷题系列答案