题目内容
【题目】某同学欲用已知物质的量浓度为0.100 0 mol·L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,如何判断滴定终点: 。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 (填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若第一次滴定开始和结束时,酸式滴定管中的液面如下图所示。则起始读数为V1= mL,终点读数V2= mL。
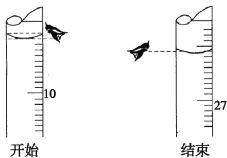
(4)再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是 mol·L-1。
滴定次数 | 待测溶液体积/mL | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | V1 | V2 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
【答案】
(1)加入最后一滴盐酸,溶液的颜色由红色变为无色,半分钟不恢复原色,立即停止滴定。
(2)DE(3)9.00 26.12(26.10~26.20间都可给分) (4)0.1710
【解析】
试题分析:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,当加入最后一滴盐酸,溶液的颜色由红色变为无色,半分钟不恢复原色,此时为滴定终点,应立即停止滴定;
(2)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液被稀释,造成V(标准)偏大,根据c(待测)=![]() 分析,测定c(NaOH)偏大,故A错误;B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,故B错误;C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
分析,测定c(NaOH)偏大,故A错误;B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,故B错误;C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 分析,测定c(NaOH)偏大,故C错误;D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=
分析,测定c(NaOH)偏大,故C错误;D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=![]() 分析,测定c(NaOH)偏小,故D正确;E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出,消耗标准液偏小,测定c(NaOH)偏小,故E正确;故答案为DE;
分析,测定c(NaOH)偏小,故D正确;E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出,消耗标准液偏小,测定c(NaOH)偏小,故E正确;故答案为DE;
(3)起始读数为9.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL;
(4)第一次消耗标准液的体积为26.10mL-9.00mL=17.10mL;第二次:17mL;第三次:17.20mL;三次平均消耗标准液为17.10mL,用c(HCl)=0.1mol/L的盐酸测定20mL的氢氧化钠溶液,发生NaOH+HCl=NaCl+H2O,则应满足V(HCl)×c(HCl)=V(NaOH)×c(NaOH),c(NaOH)=![]() =0.1710mol/L。
=0.1710mol/L。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为___________________。
(2)稼氮砷合金材料的太阳能电池效率达40%,Ga、N、As电负性由大至小的顺序是__________________
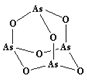
(3)As4O6的分子结构如右图所示,其中As原子的杂化方式为___________________,1 mol As4O6含有σ键的物质的量为_______________。
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示。则Y轴可表示的氢化物(RH3)性质可能是 。
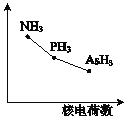
A.稳定性 | B.沸点 | C.R-H键能 | D.分子间作用力 |
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是