题目内容
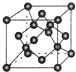
11.下列图象中,纵坐标为沉淀或气体的物质的量,横坐标为某溶液中加入的反应物的物质的量,选择合适的图象对应的字母填空.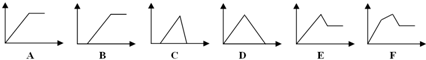
(1)澄清石灰水中通入CO2至过量D.
(2)HCl与AlCl3的混合溶液中加入NaOH至过量C.
(3)HCl与AlCl3的混合溶液中加入NH3•H2O 至过量B.
(4)MgCl2与AlCl3的混合溶液中加入NaOH至过量E.
(5)Na2CO3与NaHCO3混合溶液中加入HCl至过量B.
(6)KAl(SO4)2溶液中加入Ba(OH)2至过量E.
分析 (1)澄清石灰水中通入过量二氧化碳,先发生氢氧化钙与二氧化碳的反应生成碳酸钙沉淀,再发生碳酸钙与水、二氧化碳反应,沉淀消失,根据方程式判断前后两部分二氧化碳的物质的量关系;
(2)含少量盐酸的AlCl3溶液中滴入NaOH溶液,氢氧化钠先与盐酸反应,不产生沉淀,然后氢氧化钠与氯化铝与反应生成氢氧化铝沉淀,沉淀达最大后,氢氧化钠与氢氧化铝反应生成偏铝酸钠,最后沉淀完全溶解,根据方程式判断沉淀生成与溶解前后两部分两部分消耗的氢氧化钠的物质的量;
(3)含有少量HCl的AlCl3溶液中加入过量氨水,氨水先与盐酸发生反应,不产生沉淀,然后AlCl3溶液和氨水反应,沉淀达到最大后不能溶解在过量氨水中;
(4)AlCl3、MgCl2的混合溶液中加入过量NaOH溶液,先生成氢氧化镁、氢氧化铝两种沉淀,然后氢氧化铝与氢氧化钠反应使沉淀的量减少,但不会完全溶解;
(5)Na2CO3与NaHCO3混合溶液中加入HCl至过量,首先反应生成NaHCO3,然后生成二氧化碳和水;
(6)向KAl(SO4)2中滴加Ba(OH)2:先生成BaSO4和Al(OH)3,再加入Ba(OH)2生成的Al(OH)3溶解,剩余BaSO4沉淀,先产生沉淀,后沉淀部分溶解.
解答 解:(1)向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1,故答案为:D;
(2)向盐酸和氯化铝混合溶液中逐滴加入氢氧化钠溶液,先发生反应:HCl+NaOH=NaCl+H2O,无现象,AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,产生沉淀,后沉淀溶解,故答案为:C;
(3)含有少量HCl的AlCl3溶液中加入过量氨水,氨水先与盐酸发生反应,不产生沉淀,然后AlCl3溶液和氨水反应,沉淀达到最大后不能溶解在过量氨水中,故图象B符合,故答案为:B;
(4)AlCl3、MgCl2混合溶液中滴加NaOH溶液发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,先产生沉淀,后沉淀量减少但不会完全溶解,故图象E符合,故答案为:E;
(5)Na2CO3与NaHCO3混合溶液中加入HCl至过量,首先反应生成NaHCO3,然后生成二氧化碳和水,图象B符合,故答案为:B;
(6)向KAl(SO4)2中滴加Ba(OH)2:先生成BaSO4和Al(OH)3,再加入Ba(OH)2生成的Al(OH)3溶解,剩余BaSO4沉淀,先产生沉淀,后沉淀部分溶解,故答案为:E.
点评 本题以图象为载体考查镁铝化合物的性质,难度中等,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系.

| A. | 这种饮料不含任何化学物质 | |
| B. | 长期饮用纯水,对身体有益 | |
| C. | 这种“神奇液体”加入水中,可以“以水代油”作为发动机的燃料 | |
| D. | 没有水就没有生命 |
| A. | 第四周期 | B. | 第二周期 | C. | 第ⅣA主族 | D. | 第ⅤA主族 |
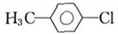
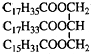 ,关于该物质的叙述正确的是( )
,关于该物质的叙述正确的是( )| A. | 一定条件下与氢气反应可以生成硬脂酸甘油酯 | |
| B. | 该物质不能使酸性KMnO4溶液褪色 | |
| C. | 与氢氧化钠溶液混合加热能得到肥皂的主要成分 | |
| D. | 与其互为同分异构且完全水解后产物相同的油脂还有三种 |
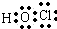 .家用消毒剂与洁厕剂(主要成分是含N的无氧酸)不宜混用,以防产生刺激性的有毒气体,请写出该反应的离子方程式:ClO-+Cl-+2H+═Cl2↑+2H2O
.家用消毒剂与洁厕剂(主要成分是含N的无氧酸)不宜混用,以防产生刺激性的有毒气体,请写出该反应的离子方程式:ClO-+Cl-+2H+═Cl2↑+2H2O .
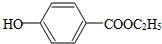
. 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:

 (一种常见化妆品的防霉剂),其生产过程如下图(反应条件没有全部注明):
(一种常见化妆品的防霉剂),其生产过程如下图(反应条件没有全部注明):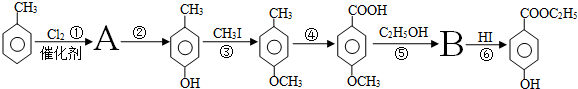
 .
. .
. .
.