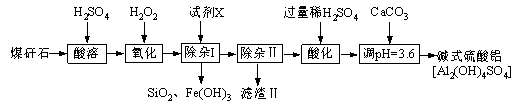
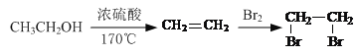题目内容
【题目】(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,

实验中发现,反应后①中的温度升高;②中的温度降低.
由此判断铝条与盐酸的反应是 热反应。
Ba(OH)28H2O与NH4Cl的反应是 热反应。
反应过程 (填“①”或“②”)的能量变化可用图2表示。.
(2)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是 (填序号)。


(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回 答下列问题:
当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为 。
【答案】(1)放 吸 ① ;(2) ② ; (3) Mg
【解析】
试题分析:(1)实验中发现,反应后①中的温度升高,说明铝条与盐酸的反应是放热反应;②中的温度降低,说明Ba(OH)28H2O与NH4Cl的反应是吸热反应。图2中反应物总能量高于生成物总能量,因此是放热反应,因此图2可以用来表示反应过程①的能量变化;
(2)①Fe作原电池的负极,Cu作正极,发生的总反应为:Fe+2Fe3+==3Fe2+,验证的是Fe3 +与Fe2+氧化性强弱,①错误;②Cu作原电池的负极,Ag作正极,发生的总反应为:Cu+2Fe3+==2Fe2++ Cu2+,可以验证Fe3 +与Cu2+氧化性强弱,②正确;③由于Fe在浓硝酸中发生钝化,因此Cu作原电池的负极,Fe作原电池的正极,电解质溶液为浓硝酸,体现的是Cu与浓硝酸的反应,不能验证Fe3+与Cu2+氧化性强弱,③错误;④Fe作原电池的负极,Cu作原电池的正极,发生的总反应为:Fe+ Cu2+== Fe2++Cu,能够验证Fe2 +与Cu2+氧化性强弱,④错误。答案为②。
(3)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,由于Mg与NaOH溶液不反应,而Al与NaOH溶液反应,因此Al作原电池的负极,发生失去电子的氧化反应,电极反应式为:Al+4OH—-3e-=AlO2-+2H2O;Mg作原电池的正极,氢离子在正极上得到电子生成氢气。