��Ŀ����
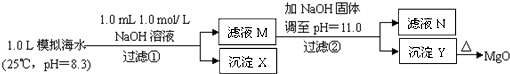
��ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�Mg0��ʵ�鷽����������
��֪��Kap[Mg(OH)4]=5.61��10-12 ����˵����ȷ���ǣ������� |
����������٣�����0.001mol NaOHʱ��OH- ǡ����HCO3-��ȫ��Ӧ������0.001molCO32-������Ksp��CaCO3������Ksp��MgCO3�������ɵ�CO32-��ˮ�е�Ca2+��Ӧ����CaCO3 ��������ҺM��ͬʱ������Ca2+��Mg2+��
����ڣ�����ҺM�м���NaOH ���壬����pH=11����pOH=3��ʱ����ʱ��Һ��c��OH-��=1��10-3 mol?L-1��
�����ܶȻ����ж���Ca��OH��2���ɣ���Mg��OH��2��������
����ڣ�����ҺM�м���NaOH ���壬����pH=11����pOH=3��ʱ����ʱ��Һ��c��OH-��=1��10-3 mol?L-1��
�����ܶȻ����ж���Ca��OH��2���ɣ���Mg��OH��2��������
����⣺A������٣����������������֪n��NaOH ��=0.001mol��[��n��OH-��=0.001mol]���������ӷ�Ӧ�����к͡�����������������ķ�Ӧ���ɣ���1Lģ�⺣ˮ�У�����0.001mol NaOHʱ��OH- ǡ����HCO3-��ȫ��Ӧ��OH-+HCO3-=CO32-+H2O������0.001molCO32-������Ksp��CaCO3������Ksp��MgCO3�������ɵ�CO32-��ˮ�е�Ca2+��Ӧ����CaCO3 ����Ca2++CO32-=CaCO3�������Գ�����XΪCaCO3����A��ȷ��
B������CO32-ֻ��0.001mol����Ӧ����CaCO3 �����ĵ�Ca2+Ҳֻ��0.001mol����Һ�л�ʣ��c��Ca2+��=0.010 mol?L-1����ҺM��ͬʱ������Ca2+��Mg2+����B����
C������ڣ�����ҺM�м���NaOH ���壬����pH=11����pOH=3��ʱ����ʱ��Һ��c��OH-��=1��10-3 mol?L-1����
Q[Ca��OH��2]=c��Ca2+������10-3��2=0.010����10-3��2=10-8��Ksp[Ca��OH��2]����Ca��OH��2���ɣ�
Q[Mg��OH��2]=c��Mg2+������10-3��2=0.050����10-3��2=5��10-8��Ksp[Mg��OH��2]����Mg��OH��2�������ɣ�
������Ksp[Mg��OH��2]=c��Mg2+������10-3��2=5.6��10-12��c��Mg2+��=5.6��10-6��10-5����ʣ�࣬��ҺN�в�����Mg2+����C����
D�������������Ϊ����4.2 g NaOH���壬��n��NaOH��=0.105mol����0.05mol Mg2+��Ӧ��Mg2++2OH-=Mg��OH��2��������0.05 mol Mg��OH��2��ʣ��0.005 mol OH-��
����Q[Ca��OH��2]=c��Ca2+������OH-��2=0.010����0.005��2=2.5��10-7��Ksp[Ca��OH��2]��������Ca��OH��2����������������YΪMg��OH��2��������D����
��ѡA��
B������CO32-ֻ��0.001mol����Ӧ����CaCO3 �����ĵ�Ca2+Ҳֻ��0.001mol����Һ�л�ʣ��c��Ca2+��=0.010 mol?L-1����ҺM��ͬʱ������Ca2+��Mg2+����B����
C������ڣ�����ҺM�м���NaOH ���壬����pH=11����pOH=3��ʱ����ʱ��Һ��c��OH-��=1��10-3 mol?L-1����
Q[Ca��OH��2]=c��Ca2+������10-3��2=0.010����10-3��2=10-8��Ksp[Ca��OH��2]����Ca��OH��2���ɣ�
Q[Mg��OH��2]=c��Mg2+������10-3��2=0.050����10-3��2=5��10-8��Ksp[Mg��OH��2]����Mg��OH��2�������ɣ�
������Ksp[Mg��OH��2]=c��Mg2+������10-3��2=5.6��10-12��c��Mg2+��=5.6��10-6��10-5����ʣ�࣬��ҺN�в�����Mg2+����C����
D�������������Ϊ����4.2 g NaOH���壬��n��NaOH��=0.105mol����0.05mol Mg2+��Ӧ��Mg2++2OH-=Mg��OH��2��������0.05 mol Mg��OH��2��ʣ��0.005 mol OH-��
����Q[Ca��OH��2]=c��Ca2+������OH-��2=0.010����0.005��2=2.5��10-7��Ksp[Ca��OH��2]��������Ca��OH��2����������������YΪMg��OH��2��������D����
��ѡA��
������������һ����ӱ�ļ����ͷ����ƶ��⣬������ͨ������ѡ���Դ�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽��Ϊ��������Ͽ����й��ܶȻ��ĸ�����㣬��һ�������龰��̲ĵ�֪ʶ�����л����������Ҫ���������ط��������ķ�Ӧ����Һ�д��ڵ����ӣ��ƶϳ����Ƿ�������Ӷ��ó���ȷ�Ľ��ۣ�����ǿ����ʵ�����Լ���ʶ�����������ۺ��ԣ��������¿γ̵���ɫ��

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
��2011?�㽭����ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����
|
��ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����
 |


