题目内容
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) ΔH=+183 kJ/mol
2NO(g) ΔH=+183 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4 kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) ΔH=______kJ/mol
2NH3(g) ΔH=______kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_______。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
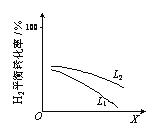
ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
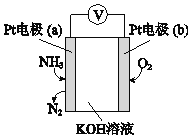
①电极b上发生的是______反应(填“氧化”或“还原”)。
②写出电极a的电极反应式_________。
【答案】-92.2K=![]() 逆向减小温度L2>L1,其他条件相同时,增大压强有利于平衡向气体体积缩小的方向移动,从而提高H2(g)的平衡转化率还原2NH3-6e-+6OH-=N2+6H2O
逆向减小温度L2>L1,其他条件相同时,增大压强有利于平衡向气体体积缩小的方向移动,从而提高H2(g)的平衡转化率还原2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)已知25℃时:
①N2(g)+O2(g)![]() 2NO(g) ΔH=+183 kJ/mol
2NO(g) ΔH=+183 kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
③4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4 kJ/mol
根据盖斯定律①+②×3/2﹣1/2×③得N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2kJ/mol;
2NH3(g)△H=-92.2kJ/mol;
(2)①因为平衡常数等于生成物浓度的幂次方之积与反应物浓度的幂次方之积的比值,所以N2(g)+3H2(g)![]() 2NH3(g)的平衡常数表达式为K=
2NH3(g)的平衡常数表达式为K=![]() ;
;
②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以按投料Ⅱ进行反应平衡时H2的浓度为3.0mol/L×(1-40%)=1.8mol/L>1.5mol/L,所以按投料Ⅱ进行反应,起始时反应进行的方向为逆向;
③由(1)得出合成氨为放热反应,所以升高温度平衡向逆反应方向移动,所以反应的化学平衡常数变小;
④i、由图可知,X越大,氢气转化率越低,升高温度平衡向逆反应方向移动,则氢气转化率减小,则X表示温度;
ii、由N2(g)+3H2(g)![]() 2NH3(g)△H<0可知温度高,氢气转化率减小,压强大,平衡正向移动,氢气转化率增大,图中等温度时L2对应的氢气转化率增大,则压强L1<L2;
2NH3(g)△H<0可知温度高,氢气转化率减小,压强大,平衡正向移动,氢气转化率增大,图中等温度时L2对应的氢气转化率增大,则压强L1<L2;
(3)①Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原发生还原反应;
②因为a极为负极,负极是氨气发生失去电子的氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O。

 阅读快车系列答案
阅读快车系列答案【题目】某班同学用如下实验探究Fe2+、Fe3+和FeO42-的性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________;将FeCl3晶体溶于浓盐酸,再稀释到需要的浓度,盐酸的作用是________。
(2)制备K2FeO4(夹持装置略)后,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |

Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。根据K2FeO4的制备原理3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O得出:氧化性Cl2______FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。