题目内容
(2013?肇庆一模)关于下列装置说法正确的是( )
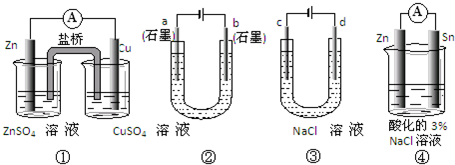

分析:A、在原电池中,电解质里的阳离子移向正极;
B、在电解池中,阴极发生得电子的还原反应;
C、精炼铜时,阳极是粗铜,阴极是纯铜;
D、在原电池中,电子从负极流向正极,根据工作原理来确定电极反应的现象;
B、在电解池中,阴极发生得电子的还原反应;
C、精炼铜时,阳极是粗铜,阴极是纯铜;
D、在原电池中,电子从负极流向正极,根据工作原理来确定电极反应的现象;
解答:解:A、装置①原电池中,Zn是负极,Cu是正极,硫酸铜溶液中铜离子减小,所以依据溶液中电荷守恒判断,电解质里的阳离子K+移向正极,即移向硫酸铜溶液,故A错误;
B、在装置②电解池中,阴极a极是氢离子发生得电子生成氢气的还原反应,该极附近碱性增强,所以a极附近溶液的pH增大,故B正确;
C、装置③精炼铜时,阳极d极应该是粗铜,阴极c极是纯铜,故C错误;
D、在装置④原电池中,电子从负极Zn即流向正极Sn极,在Sn电极上氢离子得电子生成氢气,反应实质是金属锌和氢离子之间的反应,故D正确;
故选BD.
B、在装置②电解池中,阴极a极是氢离子发生得电子生成氢气的还原反应,该极附近碱性增强,所以a极附近溶液的pH增大,故B正确;
C、装置③精炼铜时,阳极d极应该是粗铜,阴极c极是纯铜,故C错误;
D、在装置④原电池中,电子从负极Zn即流向正极Sn极,在Sn电极上氢离子得电子生成氢气,反应实质是金属锌和氢离子之间的反应,故D正确;
故选BD.
点评:本题考查学生原电池的工作原理,注意教材知识的灵活应用,属于基础知识的综合考查,难度不大.

练习册系列答案
相关题目
(2013?肇庆一模)下列实验操作、现象与结论对应关系正确的是( )
|
 (2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.
(2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.