题目内容
(2013?肇庆一模)下列说法正确的是( )
分析:A.氨基酸和蛋白质分子都含有氨基和羧基,显两性;
B.食盐中的碘元素以碘酸钾的形式存在;
C.形成酸雨的主要物质是大气中的SO2和氮氧化物;
D.蔗糖水解产物为葡萄糖和果糖,麦芽糖水解产物为葡萄糖,淀粉、纤维素最终水解产物都为葡萄糖.
B.食盐中的碘元素以碘酸钾的形式存在;
C.形成酸雨的主要物质是大气中的SO2和氮氧化物;
D.蔗糖水解产物为葡萄糖和果糖,麦芽糖水解产物为葡萄糖,淀粉、纤维素最终水解产物都为葡萄糖.
解答:解:A.氨基酸和蛋白质分子都含有氨基和羧基,显两性,既能与酸反应又能与碱反应,故A正确;
B.食盐中的碘元素以碘酸钾的形式存在,只有碘单质和淀粉发生颜色反应,故B错误;
C.形成酸雨的主要物质是大气中的SO2和氮氧化物,故C错误;
D.蔗糖水解产物为葡萄糖和果糖,麦芽糖水解产物为葡萄糖,淀粉、纤维素最终水解产物都为葡萄糖,故D错误;
故选A.
B.食盐中的碘元素以碘酸钾的形式存在,只有碘单质和淀粉发生颜色反应,故B错误;
C.形成酸雨的主要物质是大气中的SO2和氮氧化物,故C错误;
D.蔗糖水解产物为葡萄糖和果糖,麦芽糖水解产物为葡萄糖,淀粉、纤维素最终水解产物都为葡萄糖,故D错误;
故选A.
点评:本题考查物质的性质,题目难度中等,本题注意把握常见物质的性质是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(2013?肇庆一模)下列实验操作、现象与结论对应关系正确的是( )
|
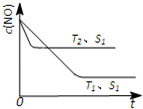 (2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.
(2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.