题目内容
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,平衡常数增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
【答案】C
【解析】
分析题给信息,该反应为气体分子数不变的可逆反应,该温度下可逆反应的平衡常数已知,可根据平衡常数的影响因素及计算进行分析求解。
A.升高温度,H2S浓度增加,说明反应向逆反应方向移动,则该可逆反应的正反应为放热反应,A项错误;
B.化学平衡常数只与温度有关,与反应物或生成物浓度无关,B项错误;
C.设反应前H2S的物质的量为x,由题意有:
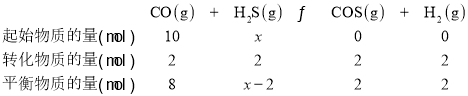
则K=![]() ,解得x=7,故可知,反应前H2S的物质的量为7mol,C项正确;
,解得x=7,故可知,反应前H2S的物质的量为7mol,C项正确;
D.由题意可知,CO的转化率=![]() ,D项错误;
,D项错误;
答案选C。

 寒假学与练系列答案
寒假学与练系列答案【题目】(1)下列3种不同粒子![]() H、
H、![]() H、
H、![]() H表示______种元素,______种核素,
H表示______种元素,______种核素,![]() H、
H、![]() H、
H、![]() H互称为__________________。
H互称为__________________。
(2)有人称煤炭是“工业的粮食”,通过煤的综合利用可以获得重要化工原料,如焦炭,它是煤的______ (填“蒸馏”或“干馏”)产物,可用于________________ (填出一种用途);以煤为原料可以制得水煤气,其反应的化学方程式为________________________________。
(3)元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度。下表列出部分短周期元素的电负性。请回答下列问题。
元素 | Al | B | Be | C | Cl | X | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Y | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
①根据上表给出的数据,可知元素的电负性越大,____________(填“金属性”或“非金属性”)越强。
②推测Y 为______(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程__________________。