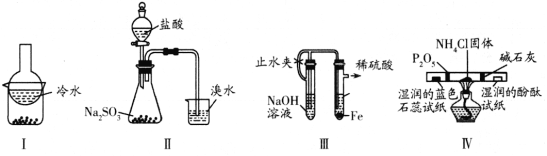
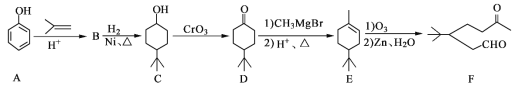
题目内容
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2![]()

TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________。
(2)丙烯分子中,碳原子轨道杂化类型为______和____。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______。
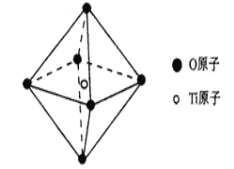
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________。
【答案】[Ar] 3d1 sp2 sp3 Cl>Mg>Al ![]() 18NA SrTiO3
18NA SrTiO3
【解析】
(1)Ti是22号元素,电子排布式为[Ar]3d24s2,Ti3+的基态核外电子排布式为[Ar]3d1。
(2)丙烯分子中,第2、3个碳原子有三个价键即为sp2杂化,第1个碳原子有四个价键即为sp3杂化。
(3)铜周期电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIIA族,因此Mg、Al、Cl第一电离能由大到小的顺序是Cl>Mg>Al。
(4)根据N = O或C2 = O,与CO互为等电子体的阴离子为CN或C22,再写其电子式。
(5)一个水有2个 σ键,1mol[Ti(H2O)6]Cl3中含有σ键的数目为(2×6 + 6)NA =18NA。
(6)该晶体的晶胞中Sr位于晶胞的顶点即![]() 个,O位于晶胞的面心即
个,O位于晶胞的面心即![]() 个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3。
个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3。
(1)Ti是22号元素,电子排布式为[Ar]3d24s2,Ti3+的基态核外电子排布式为[Ar]3d1,故答案为:[Ar]3d1。
(2)丙烯分子中,第2、3个碳原子有三个价键即为sp2杂化,第1个碳原子有四个价键即为sp3杂化,故答案为:sp2;sp3。
(3)铜周期电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIIA族,因此Mg、Al、Cl第一电离能由大到小的顺序是Cl>Mg>Al,故答案为:Cl > Mg > Al。
(4)根据N = O或C2 = O,与CO互为等电子体的阴离子为CN或C22,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(5)一个水有2个 σ键,1mol[Ti(H2O)6]Cl3中含有σ键的数目为(2×6 + 6)NA =18NA,故答案为:18NA。
(6)该晶体的晶胞中Sr位于晶胞的顶点即![]() 个,O位于晶胞的面心即
个,O位于晶胞的面心即![]() 个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3,故答案为:SrTiO3。
个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3,故答案为:SrTiO3。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】下列热化学方程式正确的是( )
选项 | 已知条件 | 热化学方程式 |
A | H2的燃烧热为a kJ·mol-1 | H2+Cl2 |
B | 1 mol SO2、0.5 mol O2完全反应,放出热量98.3 kJ | 2SO2(g)+O2(g) ΔH=-98.3 kJ·mol-1 |
C | H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 | H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 |
D | 31 g白磷比31 g红磷能量多b kJ | P4(白磷,s)=4P(红磷,s)ΔH=-4b kJ·mol-1 |
A.AB.BC.CD.D