题目内容
2.某学习小组为探究维生素C的组成和有关性质,进行了以下实验:取维生素C样品研碎,称取该试样0.704g,置于铂舟并放人燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水CaCl2和碱石灰,两者分别增重0.288g和1.056g,生成物完全被吸收.请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是0.032mo1;碳元素的质最是0.288g.
(2)维生素C中含(填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知氢、碳的质量之和小于所取样品的质量.如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写.称取试样中氧原子的物质的量为0.024molmol.
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是维生素C的相对分子质量.
分析 (1)生成物通过无水硫酸铜吸收水,通过碱石灰吸收二氧化碳,根据质量变化计算出水和二氧化碳的量,再根据n=$\frac{m}{M}$计算出水和二氧化碳的物质的量,从而得出氢原子的物质的量,最后根据m=nM计算出碳元素的质量;
(2)根据水和二氧化碳的量计算出维生素C含有的氢元素和碳元素的质量和,与样品质量比较,即可得出,m(H)+m(C)=0.032×1+0.288=0.32g<0.704g,所以确定含有氧元素,并能计算出氧元素的物质的量,得出C、H、O元素的物质的量比,再结合维生素C摩尔质量得出分子式;
(3)根据(3)可知,确定维生素C的分子式,还需要知道维生素C的相对分子质量.
解答 解:(1)生成物通过无水硫酸铜吸收水,通过碱石灰吸收二氧化碳,根据质量变化计算出水和二氧化碳的量,n(H)=2n(H2O)=$\frac{0.288}{18}$mol×2=0.032mol,n(C)=n(CO2)=$\frac{1.056g}{44g/mol}$=0.024mol,则m(C)=0.024mol×12g/mol=0.228g,
故答案为:0.032;0.288;
(2)根据水和二氧化碳的量计算出维生素C含有的氢元素和碳元素的质量和,与样品质量比较,即可得出,m(H)+m(C)=0.032×1+0.288=0.32g<0.704g,所以确定含有氧元素,并氧元素的物质的量为:$\frac{0.704-0.32}{16}$=0.024mol,
故答案为:含;氢、碳的质量之和小于所取样品的质量;0.024mol;
(3)根据(2)的计算,得出C、H、O元素的物质的量比,再结合维生素C摩尔质量得出分子式,所以还应该知道维生素C的相对分子质量,
故答案为:维生素C的相对分子质量.
点评 本题考查有机物分子式、有机物结构与性质,题目难度中等,注意掌握掌握常见有机物结构与性质,明确质量守恒定律在确定有机物分子式中的应用.

| A. | 用石灰石-石膏法可以消除燃煤烟气中的二氧化硫,同时还得到副产品石膏(CaSO3•2H2O)和亚硫酸铵 | |
| B. | 利用太阳能光电转化材料组装的器件,只要光电转化效率都达到10%,利用太阳投射到地球上能量的0.1%就能满足当前全世界能源需要 | |
| C. | 借助扫描隧道显微镜,能实现对原子或分子的操纵 | |
| D. | 道尔顿提出的原子学说、阿伦尼乌斯创立的电离学说、门捷列夫提出的元素周期律都对化学学科的发展作出了重要的贡献 |
| A. | 对该反应体系加热 | B. | 加入少量NaCl溶液 | ||
| C. | 不用锌片,改用锌粉 | D. | 加入少量1 mol•L-1硫酸 |
| A. | Mg2+、Al3+、Cl-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ar | D. | Mg2+、Na+、Cl-、S2- |
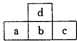 如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )
如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )| A. | a、b、c的最高价氧化物对应水化物的酸性强弱关系为c>b>a | |
| B. | d的氢化物比b的氢化物稳定 | |
| C. | 非金属性:c>b>a | |
| D. | 原子半径:c>b>a>d |
