题目内容
【题目】氮及其化合物在工农业生产、生活中有着重要作用。
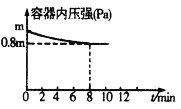
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N2![]() 2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为____mol·L-1·min-1。
2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为____mol·L-1·min-1。
(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容 器中。
①下列各项能说明该反应已达到平衡状态的是_______(填序号)。
a.容器内N2、H2、NH3的浓度之比为l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比 ________ (填“变大”“变小”或“不变”)。
(3)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。氨气能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g) ![]() H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ![]() H=-bkJ·mol-1
H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:_______________。
若标准状况下NO与NO2混合气体40.32L被足量氨水完全吸收,产生标准状况下氮气42.56L。该混合气体中NO与NO2的体积之比为________。
【答案】 0.0125 bde 变大 8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H=—(6a+7b)/5kJ·mol-1 1:2
【解析】(1)利用压强之比是物质的量之比计算反应后的物质的量,然后利用方程式根据v=△c/△t计算;
(2)①根据平衡状态的含义、特征解答;
②根据压强对平衡状态的影响分析;
(3)根据盖斯定律计算;利用方程式计算。
(1)分析题给图像知,反应体系中的压强由起始状态的m变为平衡状态的0.8m,根据阿伏加德罗定律:在等温等容的条件下,气体的压强之比等于气体的物质的量之比知,容器内气体的总物质的量有反应前的1.0mol变为平衡后的0.8mol,气体的物质的量减少0.2mol;结合反应3H2+N2![]() 2NH3利用差量法分析知,气体减少的物质的量与生成的氨气的物质的量的相等,即为0.2mol,浓度是0.2mol÷2L=0.1mol/L,则根据公式v=△c/△t可知8 min内分钟NH3的平均生成速率为0.1mol/L÷8min=0.0125 mol·L-1·min-1;
2NH3利用差量法分析知,气体减少的物质的量与生成的氨气的物质的量的相等,即为0.2mol,浓度是0.2mol÷2L=0.1mol/L,则根据公式v=△c/△t可知8 min内分钟NH3的平均生成速率为0.1mol/L÷8min=0.0125 mol·L-1·min-1;
(2)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.平衡时N2、H2、NH3的浓度之比不一定为l:3:2,a错误;b.由3v正(N2)=v逆(H2)得v正(N2):v逆(H2)=1:3,等于化学计量数之比,反应达到平衡状态,b正确;c.由3v正(H2)=2v逆(NH3)得v正(H2):v逆(NH3)=2:3,不等于化学计量数之比,反应没有达到平衡状态,c错误;d.由于反应在容积可变的密闭容器中进行,混合气体的密度随反应的进行不断变化,当其保持不变时已达平衡,d正确;e.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器中气体的平均相对分子质量不随时间而变化,已达平衡,e正确,答案选bde;
②合成氨的反应正向为气体物质的量减小的反应,等温等压条件下达到平衡与等温等容条件下达到平衡相比,相当于缩小容器的体积,平衡正向移动,NH3的体积分数变大;
(3)已知:
①2NH3(g)+5NO2(g)=7NO(g)+3H2O(g) △H=-akJ·mol-1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-bkJ·mol-1
利用盖斯定律:(①×6+②×7)÷5得NH3直接将NO2还原为N2的热化学方程式为8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H=-(6a+7b)/5kJ·mol-1;根据反应②和③列方程组计算;设NO的物质的量为x,NO2的物质的量为y,根据题意知x+y=40.32L÷22.4L/mol=1.8mol,5/6x+7/6y=42.56L÷22.4L/mol=1.9mol,解得x=0.6mol,y=1.2mol,则该混合气体中NO与NO2的体积之比为1:2。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】要除去下列各组物质中的少量杂质,所选试剂和方法可行的是( )
选 项 | 物 质 | 杂 质 | 试剂、方法 |
A | CO2气体 | HCl气体 | 通过NaOH溶液,洗气 |
B | 铜粉 | 镁粉 | 硫酸,过滤 |
C | FeCl2溶液 | ZnCl2 | 加入适量铁粉,过滤 |
D | MnO2 | KMnO4 | 加 热 |
A.AB.BC.CD.D