题目内容
8.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 常温常压下,11.2L的氧气所含的分子数为NA | |
| B. | 含Cl-数目为0.4NA的CaCl2溶液,CaCl2的物质的量浓度是0.2mol/L | |
| C. | 1.8gNH4+ 中含有的电子数为NA | |
| D. | 标准状况下,含NA个氮原子的N2 和N2O混合气体中,N2 的体积是5.6L |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、溶液体积不明确;
C、求出铵根离子的物质的量,然后根据铵根离子为10电子微粒来分析;
D、N2 和N2O中均含2个氮原子.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氧气的物质的量小于0.5mol,故含有的分子个数小于0.5NA个,故A错误;
B、含Cl-数目为0.4NA的CaCl2溶液,CaCl2的物质的量为0.2mol,但由于溶液体积不明确,故其浓度无法计算,故B错误;
C、1.8g铵根离子的物质的量n=$\frac{1.8g}{18g/mol}$=0.1mol,而铵根离子为10电子微粒,故0.1mol铵根离子中含有的电子的物质的量为1mol,个数为NA个,故C正确;
D、标准状况下,含NA个氮原子的N2 和N2O混合气体中,由于N2 和N2O中均含2个氮原子,故此混合气体的物质的量为0.5mol,但其中氮气的物质的量和体积均无法确定,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )


| A. | 氢氧化钾与硫酸的反应 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(0H)2•8H20晶体与NH4C1固体的反应 |
16.下列说法错误的是( )
| A. | 气体单质中一定存在σ键,可能存在π键 | |
| B. | 具有下列价电子排布式的基态原子中,①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ | |
| C. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| D. | BF3、NCl3、H2O、XeF4、BeCl2分子中所有原子都满足最外层为8电子结构的是NCl3 |
3.用分液漏斗可以分离的一组液体混合物是( )
| A. | 溴和四氯化碳 | B. | 硝基苯和水 | C. | 苯和溴苯 | D. | 汽油和乙醇 |
4.下列物质中:①氯水;②浓硫酸;③溴蒸气;④烧碱;⑤氧气;⑥酸性KMnO4溶液,其中在一定条件下可以与甲烷发生化学反应的是( )
| A. | ①②③⑤ | B. | ④⑤⑥ | C. | ③⑤ | D. | ②③④⑥ |
11.下列有关化学用语的表示正确的是( )
| A. | 过氧化氢的电子式为  | B. | 1,3-二甲基丁烷  | ||
| C. | Na+的结构示意图为 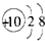 | D. | 乙烯的结构式为 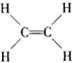 |
8.工业合成氨中常采用下列措施,其中不能用平衡移动原理解释的是( )
| A. | 使用铁触媒 | B. | 提高压强 | C. | 将氨液化分离 | D. | 增大N2浓度 |
9.碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g)+I2(?)═2HI(g);△H=-9.48kJ•mol-1
②H2(g)+I2(?)═2HI(g);△H=+26.48kJ•mol-1
下列判断正确的是( )
①H2(g)+I2(?)═2HI(g);△H=-9.48kJ•mol-1
②H2(g)+I2(?)═2HI(g);△H=+26.48kJ•mol-1
下列判断正确的是( )
| A. | ②的反应物总能量比①的反应物总能量低 | |
| B. | ①中的I2为固态,②中的I2为气态 | |
| C. | ①的产物比②的产物热稳定性更好 | |
| D. | 1mol固态碘升华时将吸热17kJ |