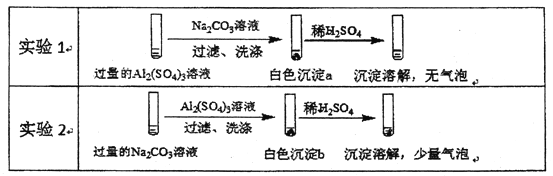
题目内容
【题目】甲醇是人们开发和利用的一种新能源。
已知①2H2(g)+O2(g)===2H2O(l)ΔH1=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9 kJ/mol。

(1)甲醇蒸气完全燃烧的热化学反应方程式_______。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
(3)H2(g)的燃烧热为________,分析H2(g)作为能源比甲醇蒸气作为能源的优点:_____(写出两点即可)
【答案】 CH3OH(g)+3/2O2(g)===CO2(g)+2H2(g)ΔH=-764.7 kJ/mol E1-E2 285.9kJ/mol 热值高;产物无污染
【解析】(1)由盖斯定律可知,1mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水时放出的热量为①+②,则热化学反应方程式:CH3OH(g)+3/2O2(g)===CO2(g)+2H2(g) ΔH2=-764.7 kJ/mol;
(2)ΔH2=生成物总能量—反应物总能量= E1-E2 kJ/mol;
(3)由燃烧热定义可知,1mol氢气完全燃烧生成液态水的放出的热量,由①可知H2(g)的燃烧热为285.9kJ/mol;等质量的H2(g)和甲醇蒸气完全燃烧释放的能量是氢气多且氢气燃烧产物没有污染。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目