题目内容
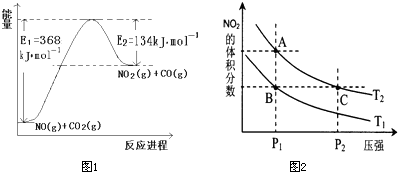
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式______.若在反应体系中加入催化剂使反应速率增大,则E1的变化是______,该反应的反应热△H______(填“增大”“减小”或“不变”).
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ?mol-1
则反应CO(g)+
 O2(g)=CO2(g)的△H=______kJ?mol-1
O2(g)=CO2(g)的△H=______kJ?mol-1(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)=2NH3(g)+
 O2(g)△H=a kJ?mol-1
O2(g)△H=a kJ?mol-1为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(4)在一固定容积为2L的密闭容器内加人2mol NH3和3mol O2,发生反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),2min后达到平衡,生成1.2mol NO.则前2分钟的平均反应速率v(NH3)为______,平衡时O2的转化率为______,该反应平衡常数的表达式K=______.
(5)某温度下,体积均为0.25L的两个恒容密闭容器中发生下列反应:N2(g)+3H2(g)
 2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:
2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:| 容器 编号 | 起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | △H1=-23.1 | |
| B | 0.9 | 2.7 | 0.2 | △H2 |
【答案】分析:(1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;根据催化剂能降低反应的活化能,但不影响反应热的大小;
(2)据盖斯定律,利用后2个化学方程式就可以求出反应的焓变;
(3)根据温度对化学平衡移动方向的影响来判断反应的吸放热情况;根据正反应气体的物质的量减小,混乱度减小来分析△s;
(4)先根据化学反应速率V= =
=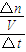 求NO的速率,然后利用系数之比等于化学反应速率之比来求NH3的速率;根据变化的各物质的物质的量之比等于化学计量数之比求出反应的氧气的物质的量,然后求出消耗氧气的物质的量,然后根据转化率等于已反应的物质的量除以原来的物质的量;根据化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
求NO的速率,然后利用系数之比等于化学反应速率之比来求NH3的速率;根据变化的各物质的物质的量之比等于化学计量数之比求出反应的氧气的物质的量,然后求出消耗氧气的物质的量,然后根据转化率等于已反应的物质的量除以原来的物质的量;根据化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(5)利用A容器反应热计算生成氨气的物质的量,根据等效平衡判断B容器反应的氮气的物质的量,最后根据物质的量与热量的关系求解.
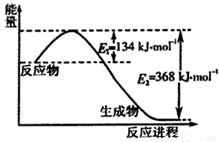
解答:解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
催化剂能降低反应的活化能,但不影响反应热的大小,所以在反应体系中加入催化剂使反应速率增大,则E1减小,该反应的反应热△H不变,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;减小;不变;
(2)N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1 ①
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ?mol-1 ②
根据盖斯定律, ,得:CO(g)+
,得:CO(g)+ O2(g)=CO2(g)△=-283kJ?mol-1,
O2(g)=CO2(g)△=-283kJ?mol-1,
故答案为:-283;
(3)由表知温度越高,氨气的量越大,即升高温度,平衡向右进行,所以正反应是吸热反应,△H>0;
正反应气体的物质的量减小,混乱度减小,所以△s<0;
故答案为:>;<;
(4)NO的速率V(NO)=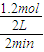 =0.3mol/(L?min),前2分钟的平均反应速率v(NH3)=V(NO)=0.3mol/(L?min),2min后达到平衡,生成1.2mol NO,则消耗了1.5molO2,所以氧气的转化率为:
=0.3mol/(L?min),前2分钟的平均反应速率v(NH3)=V(NO)=0.3mol/(L?min),2min后达到平衡,生成1.2mol NO,则消耗了1.5molO2,所以氧气的转化率为: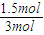 ×100%=50%,反应平衡常数的表达式K=
×100%=50%,反应平衡常数的表达式K=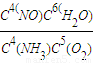 ,
,
故答案为:0.3mol/(L?min);50%;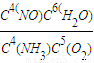 ;
;
(5)容器中放出23.1kJ热量,则生成氨气的物质的量为: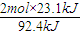 =0.5mol,利用三段式法计算:
=0.5mol,利用三段式法计算:
N2(g)+3H2(g)?2NH3(g)△H=一92.4kJ/mol
起始:1mol 3mol 0
转化:0.25mol 0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以B容器的反应正向进行,达到平衡时消耗0.15molN2,所以放出的热量为0.15mol×92.4kJ/mol=13.86
kJ;
故答案为:13.86.
点评:本题考查了热化学方程式、化学平衡常数、化学平衡移动、化学反应速率的计算等,题目较为综合,难度中等,注意做题方法、判断规律的积累.
(2)据盖斯定律,利用后2个化学方程式就可以求出反应的焓变;
(3)根据温度对化学平衡移动方向的影响来判断反应的吸放热情况;根据正反应气体的物质的量减小,混乱度减小来分析△s;
(4)先根据化学反应速率V=
 =
=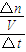 求NO的速率,然后利用系数之比等于化学反应速率之比来求NH3的速率;根据变化的各物质的物质的量之比等于化学计量数之比求出反应的氧气的物质的量,然后求出消耗氧气的物质的量,然后根据转化率等于已反应的物质的量除以原来的物质的量;根据化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
求NO的速率,然后利用系数之比等于化学反应速率之比来求NH3的速率;根据变化的各物质的物质的量之比等于化学计量数之比求出反应的氧气的物质的量,然后求出消耗氧气的物质的量,然后根据转化率等于已反应的物质的量除以原来的物质的量;根据化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;(5)利用A容器反应热计算生成氨气的物质的量,根据等效平衡判断B容器反应的氮气的物质的量,最后根据物质的量与热量的关系求解.
解答:解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
催化剂能降低反应的活化能,但不影响反应热的大小,所以在反应体系中加入催化剂使反应速率增大,则E1减小,该反应的反应热△H不变,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;减小;不变;
(2)N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1 ①
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ?mol-1 ②
根据盖斯定律,
 ,得:CO(g)+
,得:CO(g)+ O2(g)=CO2(g)△=-283kJ?mol-1,
O2(g)=CO2(g)△=-283kJ?mol-1,故答案为:-283;
(3)由表知温度越高,氨气的量越大,即升高温度,平衡向右进行,所以正反应是吸热反应,△H>0;
正反应气体的物质的量减小,混乱度减小,所以△s<0;
故答案为:>;<;
(4)NO的速率V(NO)=
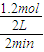 =0.3mol/(L?min),前2分钟的平均反应速率v(NH3)=V(NO)=0.3mol/(L?min),2min后达到平衡,生成1.2mol NO,则消耗了1.5molO2,所以氧气的转化率为:
=0.3mol/(L?min),前2分钟的平均反应速率v(NH3)=V(NO)=0.3mol/(L?min),2min后达到平衡,生成1.2mol NO,则消耗了1.5molO2,所以氧气的转化率为: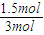 ×100%=50%,反应平衡常数的表达式K=
×100%=50%,反应平衡常数的表达式K=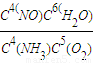 ,
,故答案为:0.3mol/(L?min);50%;
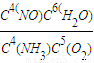 ;
;(5)容器中放出23.1kJ热量,则生成氨气的物质的量为:
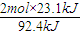 =0.5mol,利用三段式法计算:
=0.5mol,利用三段式法计算:N2(g)+3H2(g)?2NH3(g)△H=一92.4kJ/mol
起始:1mol 3mol 0
转化:0.25mol 0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以B容器的反应正向进行,达到平衡时消耗0.15molN2,所以放出的热量为0.15mol×92.4kJ/mol=13.86
kJ;
故答案为:13.86.
点评:本题考查了热化学方程式、化学平衡常数、化学平衡移动、化学反应速率的计算等,题目较为综合,难度中等,注意做题方法、判断规律的积累.

练习册系列答案
相关题目
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.