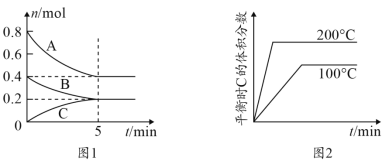
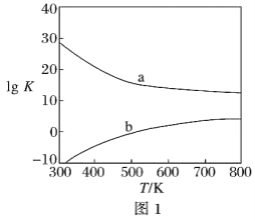
题目内容
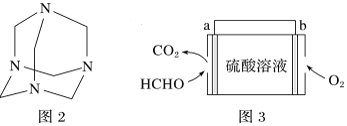
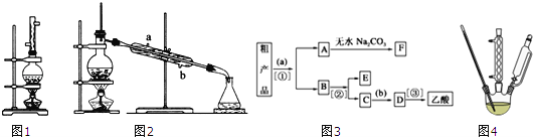
【题目】利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)
A.Y 是外接电源的正极,Fe 电极上发生还原反应
B.Ni 电极上发生的电极反应为:2H2O - 4e-== O2↑+4H+
C.若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室
D.电解后,撤去隔膜,充分混合,电解液的 pH 比原来小
【答案】D
【解析】
A. 铁电极为阳极,Y接电源的正极,铁电极上发生失电子的氧化反应:Fe+8OH--6e-=FeO42+4H2O↑,故A错误;
B. 镍电极为阴极,X接电源的负极,镍电极上发生的反应为2H2O+2e-=H2↑+2OH-,故B错误;
C. 在电解池装置中,阴离子向阳极移动,OH-由A室进入B室,故C错误;
D. 总反应为2Fe+2OH-+2H2O=FeO42+3H2↑,由于反应消耗OH-,电解的OH-浓度降低,pH比原来小,故D正确;
故选D。

【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的工艺流程如图所示,回答下列问题。
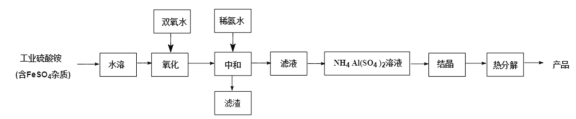
(1)“氧化”步骤发生的离子方程式为:________, 使用双氧水作氧化剂优点为:______________。
(2)“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为______________。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失
重计算值( 失重计算值(%)![]() )如表所示:
)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在______________温度区间铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是_____
(5)该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:______________。
(6)通常认为金属离子浓度等于 1×10-5mol/L 即可认为沉淀完全,试计算常温下“中和”步 骤中需要调节溶液 pH=______________(保留一位小数,已知:Ksp[Fe(OH)3 ]=8.0×10-38, lg5=0.7)。