题目内容
【题目】按下图所示装置进行实验,并回答下列问题:
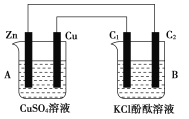
(1)判断装置的名称:A池为________,B池为________。
(2)锌极为________极,电极反应式为________;铜极为________极,电极反应式为________;石墨棒C1为________极,电极反应式为________;石墨棒C2附近发生的实验现象为________。
(3)当C2极析出224 mL气体(标准状况下)时,锌的质量变化为:________,CuSO4溶液的质量变化为:________。
【答案】(1)原电池,电解池;
(2)阴,Zn-2e-=Zn2+,正,Cu2++2e-=Cu,阳,2Cl--2e-=Cl2↑,有气泡产生,附近溶液变为红色;
(3)减少0.65g,增加了0.01 g。
【解析】
试题分析:(1)A池中锌比铜活泼,锌能和CuSO4发生氧化还原反应,构成原电池,则B池为电解池;(2)锌比铜活泼,锌作负极,电极反应式为:Zn-2e-=Zn2+,铜作正极,反应式为Cu2++2e-=Cu,C1接铜,C1作阳极,根据电解原理,阴离子放电,电极反应式为2Cl--2e-=Cl2↑,C2接锌,作阴极,电极反应式为2H++2e-=H2↑,现象:有气泡产生,附近溶液变为红色;(3)根据得失电子数目守恒,H2~2e-~Zn,锌减少224×10-3×65/22.4g=0.65g,Zn+Cu2+=Zn2++Cu,溶液质量增加0.01g。

【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)Z在元素周期表中的位置是___________________________________________。
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_________。
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为______________________________________________________________________。
(4)元素X的金属性比元素Y___(填“强”或“弱”),用原子结构的知识解释原因___________。
(5)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。

①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是_______________________________________________________。
