题目内容
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
CO(g)+
O2(g)=CO2(g)△H=-282.5kJ/mol
假如标准状况下由CH4、CO、CO2组成的89.6L混和气体完全燃烧时能放出1010kJ的热量,并生成18g液态水,那么燃烧前混和气体中CO所占的体积百分含量为( )
CO(g)+
| 1 |
| 2 |
假如标准状况下由CH4、CO、CO2组成的89.6L混和气体完全燃烧时能放出1010kJ的热量,并生成18g液态水,那么燃烧前混和气体中CO所占的体积百分含量为( )
| A.40% | B.50% | C.12.5% | D.37.5% |
生成18g即1mol液态水,则混合气体中含有的甲烷的物质的量是0.5mol,燃烧会放出的能量为445kJ,混和气体完全燃烧时能放出1010kJ的热量,所以一氧化碳共放出的能量为565kJ,所以一氧化碳的物质的量是2mol,CH4、CO、CO2组成的89.6L混和气体共4mol,所以
×100%=50%.
故选:B.
| 2 |
| 4 |
故选:B.

练习册系列答案
相关题目
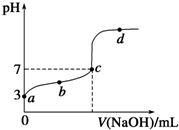
 2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是