题目内容
【题目】Ⅰ. 在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:
(1)2 min时,容器内n(N2)=________ ,c(H2)=___________。
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 _______。
Ⅱ.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行
【答案】3 mol 0.4 mol/L 9:13 ![]() 吸热 BC 830 逆向
吸热 BC 830 逆向
【解析】
I.(1)根据三段式计算2min后时各组分的物质的量,根据c=![]() 计算H2的浓度;
计算H2的浓度;
(2)计算出反应前容器内气体的总物质的量是N2和H2的物质的量的和;2 min时,容器内气体的总物质的量为N2、H2、NH3物质的量之和,据此解答;
II.(1)平衡常数为化学反应达到平衡时各种生成物浓度幂之积与反应物浓度幂之积的比;
(2)根据温度升高,平衡常数变大来分析;
(3)利用平衡的特征“等”和“定”来分析;
(4)将物质浓度关系式变性,跟化学平衡常数比较,判断其反应的温度;
(5)将该条件下的物质浓度带入浓度商式子中,得到其数值,并与该温度下的化学平衡常数K进行比较,若Qc>K,化学平衡向逆反应方向移动,若Qc=K,处于平衡状态;若Qc<K,反应正向进行,由此分析解答。
I.(1) N2与H2反应产生NH3,方程式为N2+3H2![]() 2NH3,在反应开始时,n(N2)=5mol,n(H2)=8mol,n(NH3)=0mol,2min时,n(NH3)=4mol,根据物质转化关系可知反应消耗N22mol,消耗H26mol,则2min时各种气体的物质的量分别是n(N2)=(5-2)mol=3mol,n(H2)=(8-6)mol=2mol,n(NH3)=4mol,2min时,H2的浓度c=
2NH3,在反应开始时,n(N2)=5mol,n(H2)=8mol,n(NH3)=0mol,2min时,n(NH3)=4mol,根据物质转化关系可知反应消耗N22mol,消耗H26mol,则2min时各种气体的物质的量分别是n(N2)=(5-2)mol=3mol,n(H2)=(8-6)mol=2mol,n(NH3)=4mol,2min时,H2的浓度c=![]() =0.4mol/L;
=0.4mol/L;
(2)反应前容器内气体的总物质的量是N2和H2的物质的量的和,n(N2)+ n(H2)=5mol+8mol=13mol,2 min时,容器内气体的总物质的量为N2、H2、NH3物质的量之和,n= n(N2)+n(H2)+n(NH3)=3mol+2mol+4mol=9mol,所以2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为n(后):n(前)=9:13;
II. (1)平衡常数为化学反应达到平衡时各种生成物浓度幂之积与反应物浓度幂之积的比,则CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=![]() ;
;
(2)由表格数据可知:温度升高,化学平衡常数变大可知,升高温度,平衡向正反应方向移动,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应;
(3)A.该反应为气体的物质的量不变的反应,容器中气体压强始终不变,因此压强不变不能作为判定平衡的方法,A错误;
B.混合气体中c(CO)不变,说明反应达到化学平衡,B正确;
C.v正(H2)=v逆(H2O),则对于氢气来说正、逆反应速率相等,说明反应达到平衡,C正确;
D.c(CO2)=c(CO),该反应不一定达到平衡,浓度关系取决于反应物的起始量和转化率,D错误;
故合理选项是BC;
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),则![]() =1,而K=
=1,而K=![]() ,根据温度与化学平衡常数的关系可知:反应温度为800℃;
,根据温度与化学平衡常数的关系可知:反应温度为800℃;
(5)Qc=![]() =
=![]() =1>0.9=K,说明化学平衡向逆反应方向移动。
=1>0.9=K,说明化学平衡向逆反应方向移动。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
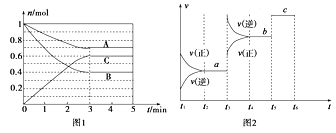
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
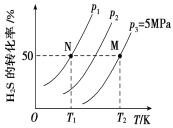
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
